Un equipo científico chileno de la Universidad de Concepción y la Universidad de la Frontera, aísla con éxito el antibiótico Emerimicina IV del hongo marino Emericellopsis minima, obtenido desde el sedimento marino a 200 metros de la costa de la Bahía de Talcahuano en Chile
Presentación
“Actividad antibiótica de Emerimicin IV aislada de Emericellopsis minima de la Bahía de Talcahuano, Chile” es un paper publicado en la revista Natural Product Research por los autores: Inostroza, A., Lara,L., Paz,C., Perez, A. Galleguillos, F., Hernandez, V., Becerra, J., González-Rocha, G. y Silva, M. Su referencia es Nat Prod Res. 2017 Jul 3:1-4. doi: 10.1080/14786419.2017.1344655.
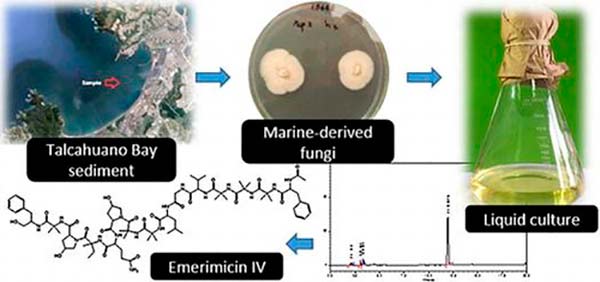
En este estudio, los científicos han logrado aislar con éxito el antibiótico Emerimicina IV a partir del hongo marino Emericellopsis minima, obtenido desde el sedimento marino a 200 metros de la costa de la Bahía de Talcahuano (Chile), con el objetivo de encontrar nuevos antibióticos, ya que la creciente aparición de bacterias multirresistentes, presenta resistencia bacteriana a los antibióticos actuales.
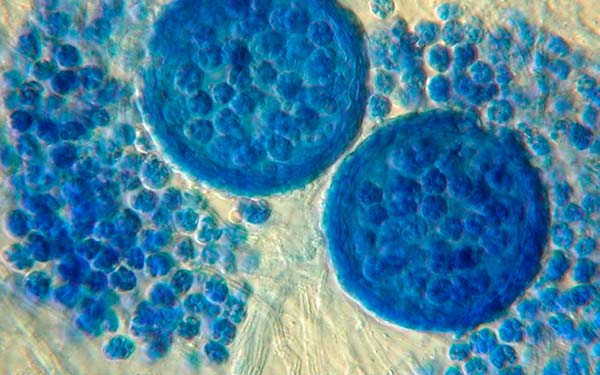
Emericellopsis minima es un hongo Ascomycetes marino que forma colonias de entre 4 y 4,5cm de diámetro. A veces presenta conidios parecidos a Acremonium. El esporocarpo es de color negruzco, de hasta 200 μm de diámetro y aparece en forma numerosa. Su asci es globosa o subglobosa formando una cleistoteca y sus ascosporas son de forma elíptica, de color marrón claro, con 3-6 alas incoloras y miden 5-6 x 2.5-3.7μm.
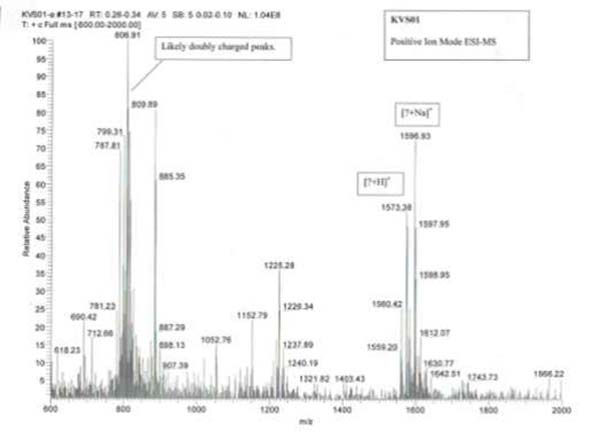
Una cepa de Emericellopsis minima fue aislada de los sedimentos marinos de la Bahía de Talcahuano (Chile), y a partir del cultivo líquido de E. minima, se aisló Emerimicin IV, un único peptaibol fúngico que mostró actividad antibacteriana. La estructura de este compuesto se asignó por interpretación de los datos obtenidos por Resonancia Magnética Nuclear Protónica (HNMR) y Cromatografía Líquida de Espectrometría de Masas (HR-LCMS). La Emerimicina IV mostró actividad bacteriostática, es decir que impide la reproducción bacteriana, contra aislados clínicos de Staphylococcus aureus resistente a la meticilina y Enterococcus faecalis resistente a la vancomicina con valores de concentración mínima inhibitoria (MIC) entre 100 y 12,5 μg/mL.
Métodos y Resultado
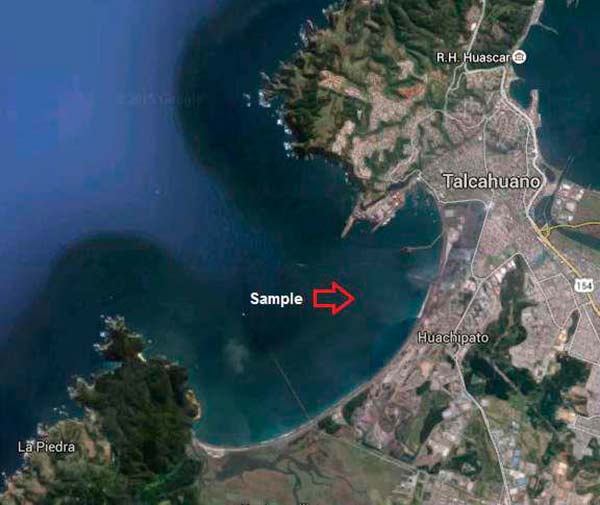
En primer lugar, en el mes de agosto de 2010, se recogieron 300g de muestras de sedimentos marinos de la Bahía de Chile (36 ° 45’07»LS, 73 ° 08’27»LW), con un Petite Ponar para muestras de poca profundidad. Posteriormente, la muestra en sí (5g) se dejó secar durante la noche en un armario de flujo laminar a temperatura ambiente.
Después, las muestras fueron suspendidas en agua de mar estéril, diluidas en serie e incubadas en medio de cultivo YPM (extracto de levadura 2,0g, peptona 2.0g y manitol 4,0g en 1L de agua de mar) a 15ºC con 200mg/L de estreptomicina sulfato. Se evaluaron las colonias de hongos seleccionadas manualmente empleando un microscopio óptico y las piezas de micelio, utilizando cultivo repetitivo para obtener una cepa pura de Emericellopsis minima.
Para la identificación de dicha cepa pura, se hizo una amplificación por PCR y una secuenciación de ADN. La extracción de ADN a partir de micelios de la cepa pura (denominada A11) se obtuvo siguiendo la metodología descrita por Doyle (1950). Para amplificar los cebadores, se utilizaron espaciadores transcritos internos (ITS) ITS1 e ITS4. El producto de la PCR se purificó y secuenció por Macrogen Co. (Corea). La identificación final de la cepa se llevó a cabo mediante la alineación de secuencias usando el algoritmo BLAST y la base de datos GenBank.
Posteriormente, se extrajeron los metabolitos a partir de piezas del micelio de la cepa A11 de Emericellopsis minima, los cuales se fermentaron durante 10 días bajo una agitación vigorosa de 150rpm a 25ºC en medio líquido YPM utilizando cuatro matraces Erlenmeyer de 500ml. Después se pasaron a matraces de 250ml con 6g de Amberlite XAD-7 cada uno. La fase sólida se filtró a través de estopilla y se eluyó con acetona.
La solución de acetona se filtró y se concentró a 37ºC, bajo presión reducida para producir un extracto total. Después de la eliminación del disolvente al vacío, se realizó un fraccionamiento de un extracto gomoso por cromatografía en columna, empleando como mezcla móvil de fase acetato de etilo y metanol para aumentar la polaridad. Las fracciones secas se probaron nuevamente para confirmar su actividad. Se realizó un bioensayo en placas de TLC para detectar el compuesto activo. Las fracciones bioactivas se separaron en HPLC semi-preparativa con un gradiente creciente de acetonitrilo en agua y un caudal de 2ml/min. Finalmente, la separación se llevó a cabo en 20 minutos a 0 min10% de ACN y 20min 100% de ACN.
Por último, se realizaron ensayos antibacterianos. Para ello, la concentración mínima inhibitoria (MIC) de Emerimicin IV fue determinada mediante el método de dilución de caldo utilizando placas de microvaloración de 96 pocillos, según el método propuesto por Michels (2011). El Emerimicin IV se disolvió en metanol hiper-grado para preparar una serie de concentraciones de doble dilución. Se inoculó cada pocillo de las placas con 260 μl de caldo de soja tríptico (TSB), 30 μl de Emerimicin iV a diferentes concentraciones, entre 200 y 6,25 μg/ml en cada pocillo, y 10 μl de una suspensión bacteriana con una concentración de 106 UFC/ml.
Se utilizaron dos series de control para evaluar el crecimiento bacteriano: una de 10 μl de suspensión bacteriana, 260 μl de TSB y 30 μl de metanol; y otra de 10 μl de suspensión bacteriana y 290 μl de TSB. La microplaca fue incubada a 35º durante 24h. Antes de la evaluación, se transfirieron 10 μl de todos los pocillos sin crecimiento bacteriano a una placa de agar Tryptic Soysin Emerimicin iV, suponiendo así la concentración mínima bactericida (MBC).
Las cepas bacterianas incluidas en este ensayo: Escherichia coli SI, Staphylococcus aureus ATCC 6538P, Kocuria rhizophila ATCC 9341 y dos cepas clínicas de Staphylococcus aureus resistente a la meticilina (cepas 14 y 32) y Enterococcus faecalis (VRE) resistente a la vancomicina 12 y 13] del Laboratorio de Investigación en Agentes Colección Antibacterianos, LIAA, Universidad de Concepción, Chile.
Fuente publicación
Este artículo está publicado originalmente en Natural Product Research, bajo la referencia: Nat Prod Res. 2017 Jul 3:1-4. doi: 10.1080/14786419.2017.1344655; cuyo Abstract aparece publicado en la web de Taylor & Francis Online y en la PubMed de NCBI.


