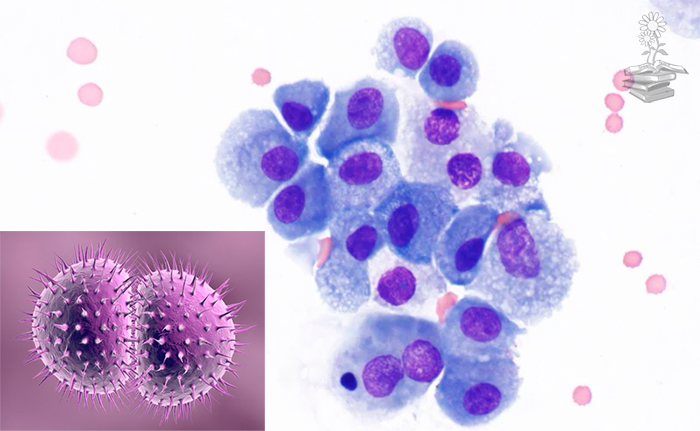
En este artículo científico, se descubre y explica cómo se produce la colonización de macrófagos humanos por Neisseria gonorrhoeae, lo cual tiene lugar mediante la alteración de la membrana plasmática de estos por colonias del patógeno.
Presentación
“Neisseria gonorrhoeae subverts formin-dependent actin polymerization to colonize human macrophages” (“Neisseria gonorrhoeae subvierte la polimerización de actina dependiente de formina para colonizar macrófagos humanos”) es un artículo científico elaborado por Ivanov, S., Castore, R., Juarez Rodríguez, M., Circu, M. y Dragoi, A., publicado en Diciembre de 2021 en la revista Plos Pathogens, en el que se explica el descubrimiento de cómo se produce la colonización de macrófagos humanos por Neisseria gonorrhoeae y se describen los reguladores clave que gobiernan dicho proceso de colonización.
Recientemente, la gonorrea ha surgido una vez más como un importante problema de salud pública mundial debido al aumento de la incidencia, así como a la rápida aparición de resistencia a los antibióticos. Un gran número de infecciones son asintomáticas, en particular en mujeres, y la transmisión de persona a persona mantiene el reservorio gonocócico dentro de la población humana. La colonización del tracto urogenital por gonococos suele desencadenar una respuesta inflamatoria localizada que, en infecciones sintomáticas agudas, puede progresar a la producción de exudado purulento que contiene gonococos, células inmunes innatas (macrófagos y leucocitos polimorfonucleares, PMN) y células epiteliales exfoliadas. Asimismo, una infección gonocócica diseminada puede provocar enfermedad inflamatoria pélvica, cicatrización de las trompas de Falopio, artritis y endocarditis.
El patógeno bacteriano adaptado a los humanos Neisseria gonorrhoeae es el agente etiológico de la enfermedad de transmisión sexual gonorrea, mientras que los macrófagos están presentes en los tejidos de la mucosa urogenital que coloniza dicha la bacteria. Este patógeno puede colonizar y replicarse cuando se cultiva con macrófagos humanos; sin embargo, la comprensión básica de cómo ocurre este proceso es incompleta.
Los autores de este trabajo, descubrieron que cuando ocurre la colonización de macrófagos humanos por Neisseria gonorrhoeae, esta puede establecer un nicho intracelular o asociado a la superficie celular que apoya la replicación bacteriana de forma independiente, pero, a diferencia de otros patógenos bacterianos intracelulares que ingresan a las células huésped como una sola bacteria, establecen un nicho intracelular y luego se replican; los gonococos invaden los macrófagos humanos como una colonia.
Los macrófagos suelen fagocitar rápidamente los diplococos individuales y transportarlos a los lisosomas para su degradación. Sin embargo, las colonias gonocócicas asociadas a la superficie pueden invadir los macrófagos al desencadenar un reordenamiento del esqueleto de actina, el cual dicta la morfogénesis de la membrana plasmática, lo que resulta en invaginaciones de esta que envuelven lentamente a la colonia. El orgánulo intracelular resultante unido a una membrana favorece una replicación bacteriana robusta. Así, las vacuolas ocupadas por gonococos evaden la fusión con el compartimento endosómico y quedan envueltas por una red de filamentos de actina.
Con este descubrimiento, los científicos demostraron que las colonias de Neisseria gonorrhoeae invaden los macrófagos mediante un proceso mecánicamente distinto de la fagocitosis, lo cual proporciona información sobre el ciclo de vida de los gonococos en asociación con macrófagos humanos y define determinantes clave de estos para la colonización de macrófagos humanos por Neisseria gonorrhoeae.
Métodos
A continuación, describimos los métodos de trabajo llevados a cabo por los investigadores.
Cepas y condiciones de cultivo bacteriano
En este estudio, se utilizaron los aislados de Neisseria gonorrhoeae FA1090, F62, MS11 y F19, que se cultivaron en medio de agar de base gonocócico (GCB) (Criterion) con suplementos de Kellog a 37°C y 5% de CO2 durante aproximadamente 16 horas. Para las infecciones, se agruparon de 4 a 6 colonias Opa+ piliadas que se sembraron en agar GCB (parche de 1×1 cm) y se cultivaron durante 16 horas. Después, se recogieron, se resuspendieron en PBSG y se determinó el número de bacterias, colocando en placas diluciones del inóculo en agar GCB. Para experimentos con bacterias muertas por calor, el inóculo se dividió y un conjunto se mató por calor a 70°C durante 30 minutos. La pérdida de viabilidad se confirmó sembrando las bacterias en agar GCB.
Además, en este estudio también se utilizó la cepa LP01 de Legionella pneumophila (Brenner DJ, Steigerwalt AG, McDade JE 1979) serogrupo 1 con una deleción limpia del gen dotA. Esta se cultivó en placas de extracto de levadura de carbón (CYE). Para los estudios de fagocitosis de macrófagos, se recogieron de este cultivo después de crecer durante 2 días a 37°C, se resuspendieron en agua y se determinó el número de bacterias.
Células humanas: condiciones de cultivo y ensayo de viabilidad
Para este trabajo sobre la colonización de macrófagos humanos por Neisseria gonorrhoeae, se empleó la línea celular monocítica humana U937 (ATCC CRL-1593.2) y células monocíticas periféricas humanas primarias (PBMC) de dos donantes diferentes.
Las células U937 se cultivaron en medio RPMI 1640 (VWR) suplementado con suero bovino fetal (FBS) al 10% a 37°C y CO2 al 5%. Para la diferenciación en macrófagos adherentes maduros, se sembraron los monocitos, se cultivaron con 10ng/ml de 12-miristato y 13-acetato de forbol (PMA) durante 24 horas, y se incubaron 48 horas con medio RPMI (+10% FBS) en ausencia de PMA. Después, se diferenciaron en macrófagos maduros, con factor estimulante de colonias de macrófagos recombinantes humanos (BioVision) en medio RPMI 1640 suplementado con suero AB humano al 20% (Corning) durante 7 días.
Para los estudios de viabilidad, las células U937 se diferenciaron directamente en placas de 96 pocillos de pared blanca y se trataron con diferentes dosis de SMIFH2 o control de vehículo (DMSO) durante 8 horas. La viabilidad celular se evaluó mediante el ensayo CellTiter Glo 2.0 (Promega), que mide la producción de ATP en células vivas. La citotoxicidad máxima (señal de luminiscencia más baja) se determinó mediante lisis hipotónica aguda.
Anticuerpos e inhibidores
El anticuerpo IgY de pollo purificado anti Neisseria gonorrhoeae fue generado contra gonococos FA1090 muertos con formalina y reacciona de forma cruzada con las cepas MS-11, FA19 y F62. También se emplearon anticuerpos policlonales y monoclonales de conejo, anticuerpos de ratón, anticuerpo anti-LAMP-2 humano (H4B4), anticuerpo anti-DIAPH2 (A300-079A-T) y anticuerpos conjugados con fluoróforo Alexa de alta absorción cruzada.
Los inhibidores utilizados en este estudio fueron: citocalasina D (5μM), CK869 (10μM), Dynasore (30μM), GSK269962 (1μM), nocodazol (3μM), ML-141 (5μM), EHT 1864 (5μM), BMS-5 (1μM), (-) blebbistatina (5μM), LY294002 (10μM) y SMIFH2 (12,5μM a 100μM).
Ensayos de supervivencia bacteriana
Los macrófagos diferenciados se infectaron con un inóculo de gonococos cultivados como un parche, a partir de 4-6 colonias piliadas en agar GCB durante 16 horas. El parche se recolectó en medio PBSG precalentado. El número de bacterias se determinó por densitometría OD550 y el MOI del inóculo fue de 1 bacteria por 10 macrófagos.
Las bacterias se agregaron a los pocillos que contenían macrófagos en PBSG o a pocillos vacíos en la misma placa. La placa se centrifugó durante 5 minutos a 1000 rpm para poner las bacterias en contacto con los macrófagos. Los recuentos de UFC de T0 se determinaron colocando una dilución del inóculo en agar GCB. En diferentes momentos posteriores a la infección, se determinó el número de gonococos en el sobrenadante y en las células lisadas mediante diluciones seriadas sembradas en agar GCB.
Ensayo de replicación bacteriana dependiente del contacto
De nuevo, macrófagos diferenciados se infectaron con un inóculo de gonococos cultivados en agar GCB durante 16 horas como un parche, iniciado a partir de 4 a 6 colonias piliadas. El parche se recolectó en medio PBSG precalentado, y el número de bacterias se determinó mediante densitometría OD550, siendo el MOI del inóculo de 2 bacterias por macrófago.
El inóculo se preparó con PBSG y la infección se llevó a cabo en este mismo medio. Se colocaron insertos con membranas Transwell de tamaño de poro inferior de 0,4μm (Corning) en cada pocillo. El inóculo se añadió dentro del inserto Transwell para medir la replicación bacteriana independiente del contacto, o en el pocillo para medir la replicación dependiente del contacto. Para establecer una línea base de replicación gonocócica en PBSG, el inóculo también se añadió a los pocillos que no contenían macrófagos.
La placa se centrifugó durante 5 minutos a 1000 rpm para poner las bacterias en contacto con los macrófagos. Los recuentos de UFC T0 se determinaron colocando una dilución del inóculo en agar GCB. También se determinó el número de gonococos en el sobrenadante y en las células.
Para confirmar la integridad de la membrana Transwell en las condiciones de crecimiento independientes del contacto, los macrófagos se lisaron con detergente, se sembraron diluciones seriadas en agar GCB y, como se esperaba, no se recuperaron UFC viables.
Microscopía de inmunofluorescencia de macrófagos infectados
Para las infecciones, los monocitos U937 se diferenciaron mediante PMA directamente en cubreobjetos en placas de 24 pocillos, mientras que los hMDM se sembraron en cubreobjetos en medio (RPMI + 10 % FBS) durante 20 horas antes de la infección. La densidad de siembra para todos los tipos de células se mantuvo en 2×105 células/pocillo. Después de la adición del inóculo, las placas de cultivo celular se centrifugaron a 1000 rpm durante 5 minutos para facilitar el contacto entre las bacterias y los macrófagos.
Para el análisis por microscopía de inmunofluorescencia, los cubreobjetos se lavaron con PBS tres veces, se fijaron con paraformaldehído (PFA) al 2% durante 60 min a temperatura ambiente, se permeabilizaron con Triton X-100 al 0,1% durante 20 min y se bloquearon con suero de cabra al 2% en PBS durante 60 min. A continuación, se añadieron los anticuerpos primarios en PBS con suero de cabra al 0,2% durante la noche a 4°C o durante 90 min a temperatura ambiente. La sonda de actina de alta afinidad Alexa Fluor-568 Phalloidin (ThermoFisher) se utilizó a una dilución de 1:2000 y se añadió con los anticuerpos secundarios. Los cubreobjetos se montaron con el reactivo anti decoloración ProLong Gold (ThermoFisher) sobre portaobjetos y se examinaron mediante microscopía de fluorescencia.
Las diferentes subpoblaciones bacterianas en la metodología de tinción de adentro hacia afuera se detectaron mediante inmunomarcaje diferencial, antes y después de la permeabilización con detergente de la membrana plasmática de la célula huésped. Brevemente, los gonococos extracelulares se inmunomarcaron con anticuerpo de conejo en suero de cabra al 2% durante 90 minutos, después de que las células infectadas se lavaran con PBS tres veces y se fijaran con PFA al 2% durante 60 minutos a temperatura ambiente. El anticuerpo se inmovilizó en las muestras con PFA al 2% (incubación de 60 minutos). A continuación, todas las bacterias se marcaron con anticuerpo IgY de pollo (Cocalico Biologicals) durante 90 minutos, después de que las muestras se permeabilizaran con Triton X-100 al 0,1% durante 20 minutos y se bloquearan con suero de cabra al 2% en PBS durante 60 minutos.
En cada micrografía, los gonococos inaccesibles a los anticuerpos fueron positivos simples, mientras que las bacterias asociadas a la superficie fueron doblemente positivas.

Análisis microscópico de células infectadas
Las imágenes se adquirieron con un microscopio de campo amplio invertido (Nikon Eclipse Ti) controlado por el software de imágenes NES Elements v4.3 (Nikon), utilizando un objetivo de aceite 60X/1,40 (Nikon Plan Apo λ), iluminación LED (Lumencor) y una cámara CCD CoolSNAP MYO.
Para todos los análisis, se adquirieron imágenes tridimensionales de campos seleccionados aleatoriamente y los parámetros se mantuvieron constantes para todos los portaobjetos del mismo experimento.
Análisis de la invasión gonocócica
Los macrófagos U937 diferenciados en cubreobjetos fueron tratados previamente con los siguientes inhibidores durante 30 minutos antes de la infección: citocalasina D (5μM), CK869 (10μM), SMIFH2 (25μM), GSK269962 (1μM), LY294002 (10μM), nocodazol (3μM), ML-141 (5μM), EHT1864 (5μM), BMS-5 (1μM), Dynasore (30μM) y (-) blebbistatina (5μM); los cuales permanecieron durante toda la infección.
Los macrófagos se infectaron con Neisseria gonorrhoeae FA1090 (MOI = 2) durante 8 horas o con Legionella pneumophila ΔdotA (MOI = 40) durante 2 horas, después de lo cual las células se lavaron exhaustivamente con PBS y se fijaron con PFA al 2%. Las muestras se procesaron para el análisis de inmunofluorescencia interna/externa (como se detalló anteriormente) y se determinó la cantidad de bacterias internalizadas mediante análisis microscópico.

Cuantificación de bacterias mediante microscopía de inmunofluorescencia 3D
Para calcular la cantidad de gonococos dentro de una colonia o la cantidad de bacterias que pueblan cada célula huésped en micrografías 3D de macrófagos colonizados por gonococos, utilizaron la metodología que desarrollaron previamente para contar células bacterianas de macrófagos infectados con Legionella. Analizando las imágenes vieron que, dentro de cada objeto, el número de bacterias variaba desde diplococos individuales hasta cientos de bacterias (en colonias grandes).
La fórmula para calcular el número de bacterias dentro de los volúmenes de un objeto (X = 0,4093*V+1,134, R2 = 0,9037, X-número de gonococos, V-volumen del objeto [vóxeles]) se derivó de los datos de las mediciones de volumen de bacterias individuales, así como de colonias bacterianas (n = 142), donde las bacterias pueden identificarse y contarse de forma inequívoca de forma manual.
Ensayos de fagocitosis de macrófagos
Los macrófagos U937 diferenciados en portaobjetos se infectaron con Neisseria gonorrhoeae FA1090 (MOI = 2) durante 7 horas. A continuación, se añadió carga fagocítica de bacterias vivas (MOI = 40) o partículas de látex durante 60 minutos, tras lo cual las células se lavaron exhaustivamente con PBS y se fijaron con PFA.
Se usó Legionella pneumophila ΔdotA para medir la fagocitosis de bacterias vivas porque este mutante es avirulento, se absorbe por fagocitosis, se desplaza a través del compartimento endocítico y muere por degradación lisosomal. Por otro lado, se utilizaron como carga IgG de conejo marcadas con FITC conjugadas con perlas de látex con un tamaño medio de partícula de 0,1μm (Cayman Chemicals).
Para determinar la internalización de la carga, se utilizó una metodología de tinción de dentro hacia fuera de la siguiente manera:
(1) fijado con PFA al 2% (60 min), lavado y bloqueado con suero de cabra al 2% en PBS;
(2) incubado con anticuerpo de conejo en presencia o ausencia (tratamiento con perlas de látex FITC-IgG) de anticuerpo de conejo anti-Legionella durante 60 min;
(3) fijado con 2% PFA (60 min), lavado y permeabilizado con 0.1% Triton X-100 durante 20 min;
(4) incubado con anticuerpo IgY anti Neisseria de pollo purificado en presencia (infecciones ΔdotA) o ausencia (tratamiento con perlas de látex FITC-IgG) de anticuerpo IgY anti-Legionella de pollo purificado durante 60 min;
(5) lavado extensivamente e incubado con anti-conejo Alexa568 de alta absorción cruzada (ThermoFisher), anti-IgY de pollo FITC (Life Technologies) y Hoescht 33342 (Molecular Probes) durante 60 min.
Microscopía electrónica de transmisión de secciones delgadas de los macrófagos
Los macrófagos U937 diferenciados se infectaron con Neisseria gonorrhoeae FA1090 durante 10 horas (MOI = 2) en cubreobjetos.
Las células se lavaron con PBS y se fijaron con glutaraldehído al 1,6% y paraformaldehído al 2,5% en tampón de cacodilato 0,1M durante 60 minutos a temperatura ambiente.
Las muestras se procesaron y se tomaron imágenes en las instalaciones del centro de imágenes de la Facultad de Medicina Veterinaria de la LSU en un microscopio electrónico de transmisión JEOL JEM-1011.
Análisis cuantitativo por PCR en tiempo real
Los macrófagos U937 sembrados en placas se infectaron con Neisseria gonorrhoeae FA1090 durante 8 horas. En paralelo, también se recogieron muestras de células no infectadas.
El aislamiento del ARN total y la síntesis de ADNc de primera cadena se realizó utilizando el kit TaqMan Gene Expression Cells-To-Ct (ThermoFisher). La cantidad de los diferentes ARNm se determinó mediante PCR cuantitativa en tiempo real utilizando Universal ProbeLibrary y LightCycler 480 Probes Master.
Generación de líneas celulares estables U937 y análisis estadístico
Se generaron líneas celulares U937 con inactivación de forminas y líneas celulares U937 que expresaban de manera estable la proteína de membrana fluorescente roja.
Por su parte, los cálculos de las diferencias estadísticas se realizaron mediante la prueba T de Student o el análisis ANOVA multiparamétrico, utilizando Prism v9 (software GraphPad).

Resultados del estudio de la colonización de macrófagos humanos por Neisseria gonorroeae
En resumen, como resultados del estudio, los científicos descubrieron que en la colonización de macrófagos humanos por Neisseria gonorrhoeae, esta establece dos nichos subcelulares distintos que apoyan la replicación bacteriana de forma autónoma: un nicho en la superficie del macrófago y otro intracelular. Para acceder al segundo, los gonococos subvirtieron el citoesqueleto de actina del huésped a través del factor de nucleación de actina FMNL3 dependiente de formina, para invadir los macrófagos colonizados y ocupar un orgánulo intracelular unido a la membrana.
En las células huésped, así como en superficies inanimadas, los gonococos se agregan para formar colonias como resultado directo de interacciones dinámicas mediadas por las proteínas Opa, los lipooligosacáridos gonocócicos y los pili tipo IV.
Por otro lado, la remodelación dinámica del citoesqueleto de actina del huésped por patógenos bacterianos es un mecanismo crítico para la invasión y propagación del huésped, y está mediada tanto por mecanismos dependientes de Arp2/3 como de formina. En este estudio, se ha visto que el complejo Arp2/3 inicia la formación de actina ramificada uniéndose a los lados de filamentos preexistentes, mientras que la familia de nucleadores dependientes de formina dirige la elongación de filamentos de actina no ramificados.
A continuación, vamos a ir viendo estos resultados con más detalle.
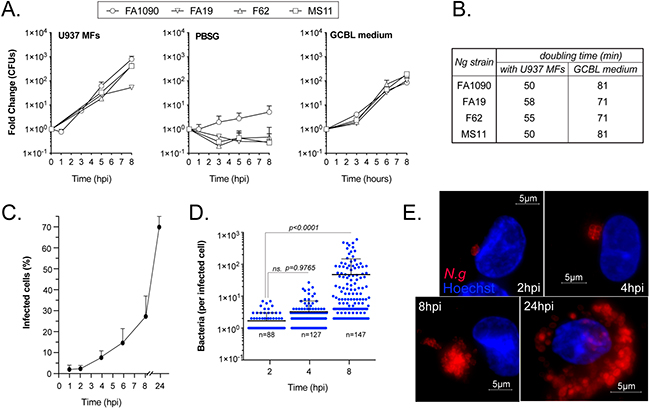
Neisseria gonorrhoeae coloniza y se replica en asociación con macrófagos humanos
Para analizar la capacidad de los macrófagos humanos de apoyar la replicación gonocócica, realizaron distintos ensayos de crecimiento. Primero, cuantificaron las unidades formadoras de colonias bacterianas (UFC) recuperadas después de la infección en experimentos de cultivo celular llevadas a cabo en condiciones de agotamiento de nutrientes en medios PBSG.
Tal y como puede verse en las figuras 1A y 1B de la imagen superior, en presencia de macrófagos humanos diferenciados de la línea celular pro-monocítica U937, las UFC gonocócicas aumentaron de 2 a 3 log10 en un período de 8 horas. Además, la cinética de crecimiento de las cepas aisladas de pacientes con infecciones gonocócicas diseminadas (FA1090, FA19) o no complicadas (F62, MS11) en infecciones por macrófagos U937 fue similar.
Asimismo, la tasa de replicación gonocócica en asociación con macrófagos humanos en PBSG (medio pobre en nutrientes) superó la tasa de crecimiento observada en el medio líquido de base gonocócica compleja (GCBL) rico en nutrientes, lo que indica que de alguna manera los gonococos recolectan nutrientes de los macrófagos.
Y mediante microscopía, determinaron que el porcentaje de MF U937 infectados aumentó de 2 a 28% y el número promedio de gonococos por macrófago también aumentó de 1,6 a 47,7 en ese período de tiempo (Figuras 1C-1E).
En conjunto, estos datos de infecciones de cultivos celulares con una multiplicidad de infección (MOI) inicial baja, demuestran la capacidad de los gonococos de colonizar macrófagos humanos, replicarse y potencialmente diseminarse a células vecinas en cuestión de horas.
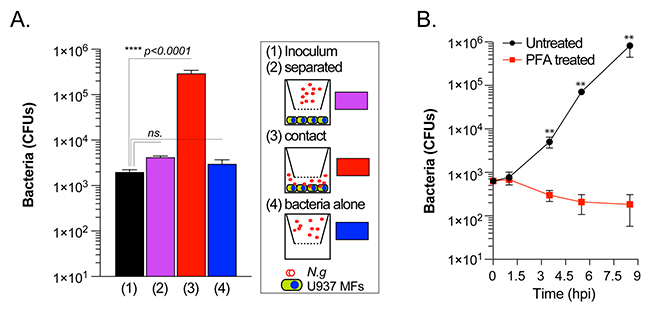
Por otra parte, cuando los gonococos se separaron de los MF U937 con una barrera de filtro de tamaño de poro de 0,4μm que permitía el intercambio de fluidos, pero impedía el contacto directo, los gonococos no se replicaron, tal y como puede verse en la Figura 2A de la imagen superior. De manera similar, los macrófagos fijados con paraformaldehído antes de la infección no favorecieron la replicación gonocócica (Figura 2B), lo que indica que se requiere contacto directo con macrófagos vivos para la adquisición de los nutrientes necesarios para la replicación gonocócica. En conjunto, estos datos demuestran que los gonococos codifican la capacidad de colonizar y replicarse en asociación con macrófagos humanos.
Neisseria gonorrhoeae ocupa múltiples nichos celulares distintos en los macrófagos humanos
El nicho celular en las infecciones por macrófagos que sustenta la replicación gonocócica era desconocido. En estudios anteriores, se han observado gonococos intracelulares así como asociados a la superficie celular. Por lo tanto, aquí investigaron la localización subcelular de las colonias gonocócicas porque esos compartimentos celulares probablemente incluyan el nicho que sustenta la replicación bacteriana. Para ello, denominaron a los grupos de 4 a 12 bacterias microcolonias y a los grupos de más de 13 miembros, colonias.
Realizaron un análisis de microscopía de inmunofluorescencia 3D de MF U937 infectados con Neisseria gonorrhoeae FA1090 durante 6 horas, donde la red de actina cortical se marcó con faloidina. La actina cortical puede distinguir las bacterias localizadas intracelulares de las de la superficie celular, ya que se forma en estrecha proximidad a la membrana plasmática. Con base a este criterio, observaron colonias de gonococos tanto intracelulares como asociadas a la superficie celular, tal y como puede verse en la siguiente Figura 3A.
Estas topologías de colonias distintas se confirmaron mediante un enfoque alternativo de microscopía de inmunofluorescencia de adentro hacia afuera, en el que las bacterias extracelulares se marcan con dos anticuerpos policlonales anti-Neisseira distintos (uno antes y otro después de la permeabilización celular), mientras que las bacterias intracelulares se marcan de manera simple, ya que son accesibles solo después de la permeabilización celular (Figura 3B).
Curiosamente, con frecuencia, se observaron colonias en mosaico que consistían en regiones teñidas con un solo anticuerpo y regiones teñidas de manera doble dentro de la misma colonia (Figura 3C). Este tipo de colonia híbrida fue producida por las cuatro cepas gonocócicas analizadas (FA1090, MS11, F62 y FA19) en infecciones por MF U937 (Figura 3D), así como en infecciones de macrófagos humanos primarios derivados de monocitos (hMDM) (Figura 3E).
Estos datos, demuestran que las colonias gonocócicas no eran exclusivamente intra o extracelulares, sino que ocupaban múltiples nichos celulares distintos en los macrófagos humanos infectados mediante un mecanismo conservado.
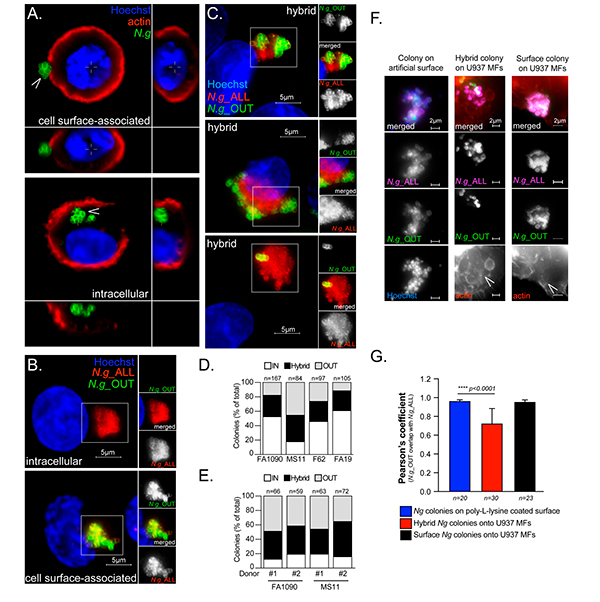
Tras esto, consideraron que la topología de colonia híbrida podría representar una colonia asociada a la superficie en la que los gonococos de la capa externa muy compactados hacen que las bacterias más internas sean inaccesibles a la unión de anticuerpos. Sin embargo, este no fue el caso porque la inmunotinción de adentro hacia afuera de las colonias de Neisseria en cubreobjetos de poli-L-lisina en ausencia de macrófagos, mostró que la mayoría de las bacterias son accesibles igualmente bien por ambos anticuerpos (Figuras 3F y 3G).
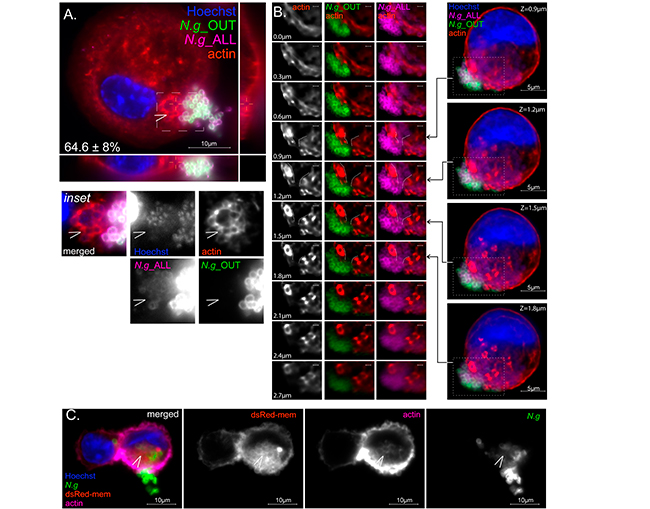
No obstante, en colonias con topología híbrida, las regiones inaccesibles a los anticuerpos penetran la capa de actina cortical y están envueltas por una red de filamentos de actina, lo cual puede observarse en la siguiente Figura 4A. Además, las colonias híbridas permanecen continuas y aparecen como una sola entidad, a pesar de que una demarcación clara entre las regiones de colonia accesibles e inaccesibles a los anticuerpos es evidente por microscopía de adentro hacia afuera (Figura 4B).
La explicación más plausible para la topología híbrida es la internalización parcial, donde los gonococos extracelulares actúan como un tapón para sellar una invaginación de la membrana plasmática que alberga la porción intracelular de la colonia. Para comprobar esto, transdujeron microfilamentos U937 con el marcador de membrana fluorescente codificado genéticamente dsRed-mem, el cual se dirigió predominantemente a la membrana plasmática de microfilamentos U937. De hecho, las invaginaciones de la membrana plasmática se localizan junto con la red de actina en las regiones proximales a las células de las colonias gonocócicas híbridas (Figura 4C).
En conjunto, estos datos indican que en los macrófagos humanos colonizados se pueden encontrar colonias gonocócicas: (i) en la superficie celular, (ii) dentro de un compartimento intracelular y (iii) parcialmente internalizadas dentro de una invaginación de la membrana plasmática.
Las colonias intracelulares de Neisseria gonorrhoeae surgen de la internalización prolongada de microcolonias asociadas a la superficie
Un gran porcentaje de diplococos de gonococos asociados a macrófagos se internalizaron y residieron dentro del compartimento endolisosomal, tal y como indica el reclutamiento de los marcadores endosómicos tempranos (EEA1) y tardíos (Rab7 y Lamp2) en las siguientes Figuras 5A y 5B. Además, se observó una cinética de internalización y tráfico similar en las infecciones de macrófagos con gonococos muertos por calor.
Debido a que los lisosomas son orgánulos degradativos que promueven la eliminación de gonococos intracelulares en infecciones por MF U937, es poco probable que los eventos de entrada temprana den lugar a las colonias intracelulares observadas en puntos temporales posteriores. Para determinar cuándo se inicia la colonización intracelular exitosa, bloquearon la fagocitosis agregando el inhibidor de polimerización de actina citocalasina D en momentos después de la infección, y evaluaron la localización de las colonias a las 8 horas (Figura 5C). Dicho pretratamiento resultó principalmente en colonias asociadas a la superficie. Sin embargo, el bloqueo de la fagocitosis, redujo notablemente el número de colonias intracelulares detectadas a las 8 h. en un 74%. Incluso a las 4 h., la adición de citocalasina D redujo las colonias intracelulares en más de un 60% (Figura 5C).
Estos resultados respaldan aún más la noción de que los diplococos fagocitados rápidamente y que son transportados a los lisosomas, no dan lugar a colonias intracelulares; y demuestran que la colonización intracelular productiva es realizada en gran medida por bacterias internalizadas en momentos posteriores.
Asimismo, un enfoque alternativo que utiliza ensayos de protección con gentamicina (un antibiótico aminoglucósido que no puede difundirse a través de las membranas biológicas), produjo resultados similares de sensibilidad completa al fármaco a 1 hora después de la infección y un aumento significativo en la población bacteriana protegida a partir de las 2 h. en adelante (Figura 5D).
En conjunto, estos datos sugieren que la colonización intracelular se lleva a cabo principalmente por gonococos que inicialmente permanecen asociados a la superficie durante dos o más horas antes de la entrada.
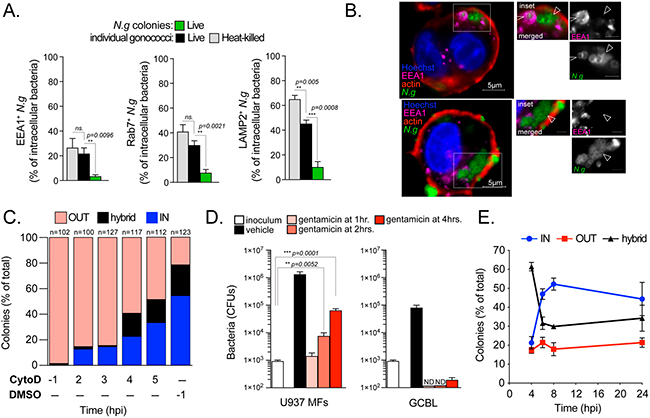
Para definir cuándo y dónde los gonococos inician la replicación, investigaron la cinética de tráfico de microcolonias gonocócicas (4-12 bacterias) como una lectura para el inicio de la replicación bacteriana. Las microcolonias fueron detectables a las 2 horas cuando los macrófagos fueron infectados con gonococos vivos pero no muertos por calor; sin embargo, la mayoría de las bacterias asociadas a las células eran diplococos y solo unos pocos macrófagos albergaban bacterias en ese momento. A las 2 hpi, la mayoría de las microcolonias estaban al menos parcialmente asociadas a la superficie. De 2 a 4 hpi, el porcentaje de microcolonias intracelulares aumentó (del 13% al 33%).
Estos datos sugieren que las colonias intracelulares son iniciadas por bacterias que experimentan una o más rondas de replicación en la superficie del macrófago para formar una colonia antes de la internalización. De acuerdo con esto, el porcentaje de colonias híbridas e intracelulares se correlacionó inversamente con el tiempo, donde las colonias con topología híbrida fueron el tipo de colonia más prevalente a las 4 hpi, pero disminuyeron en un 50 % a las 8 hpi, con un marcado aumento en las colonias intracelulares (Figura 5E).
Cabe indicar que, a pesar de la alta tasa fagocítica, la persistencia de grandes colonias estrictamente asociadas a la superficie fue sorprendente, dado que los MF U937 colonizados internalizaron eficientemente tanto las perlas recubiertas de IgG como la carga bacteriana heteróloga. La explicación más plausible para estos datos, es que algunas colonias gonocócicas resisten la fagocitosis, permanecen asociadas a la superficie y se expanden. De hecho, el bloqueo prolongado de la fagocitosis con citocalasina D no redujo la tasa de replicación bacteriana y resultó en grandes colonias de gonococos asociadas a la superficie de los macrófagos, lo que demuestra que los gonococos pueden replicarse en la membrana plasmática de los macrófagos independientemente de la internalización.
Tras esto, investigaron si en las infecciones por macrófagos los gonococos se replican intracelularmente porque, en principio, se podrían producir grandes colonias intracelulares estrictamente a través de la internalización de grandes colonias de superficie. Con este fin, midieron el cambio en el tamaño de las colonias intracelulares de 4 a 10 hpi en condiciones que bloquearon o no bloquearon la captación de bacterias a las 4 hpi. Tras esto, vieron que el volumen medio de colonias intracelulares aumentó aproximadamente 4 veces de 4 a 10 hpi independientemente del tratamiento con citocalasina D. Por tanto, las colonias gonocócicas intracelulares continúan creciendo incluso después de la internalización, lo que demuestra que en las infecciones de macrófagos los gonococos pueden establecer dos nichos celulares distintos que apoyan la replicación bacteriana: uno es intracelular y el otro está asociado a la superficie celular.
Un orgánulo único en macrófagos unido a la membrana enriquecido con actina alberga gonococos intracelulares replicantes en infecciones
Se especuló que el nicho intracelular que sustenta la replicación de los gonococos en infecciones por macrófagos tiene lugar en el citosol. Por ello, primero buscaron evidencia experimental de la replicación citosólica midiendo el reclutamiento de la lectina citosólica β-galactósida que se une a la galectina-3 de las colonias intracelulares de gonococos. La galectina-3 se utiliza con frecuencia para la identificación de bacterias invasoras del citosol porque se une a las fracciones de azúcar presentes en la superficie bacteriana, así como en las glucoproteínas luminales, a las que puede acceder tras la ruptura vacuolar.
Solo una fracción menor de diplococos intracelulares acumuló galectina-3 en MF U937, mientras que las colonias intracelulares de gonococos no lo hicieron, lo que indica que las colonias están de alguna manera protegidas de las lectinas citosólicas, aunque la galectina-3 claramente puede unirse a Neiseria gonorrhoeae.
Para determinar si una membrana separa las colonias de gonococos del citosol, realizaron microscopía electrónica de transmisión de macrófagos colonizados, lo cual confirmó que colonias de diferentes tamaños ocupaban compartimentos vacuolares unidos a la membrana, tal y como se muestra en las figuras 6B y 6C. También se observaron invaginaciones de membrana intraluminal en contacto con gonococos dentro de las grandes vacuolas que contenían gonococos (Figura 6B). En consonancia con los datos de reclutamiento de galectina-3, encontraron algunos diplococos en contacto directo con el citosol (Figura 6C).
Para investigar la localización intravacuolar de las colonias de gonococos, utilizaron MF U937 transducidos con el marcador de membrana fluorescente dsRed-mem. En los macrófagos colonizados, las colonias intracelulares estaban envueltas por dsRed-mem, lo que confirma que un orgánulo unido a la membrana albergaba a las bacterias (Figura 6E).
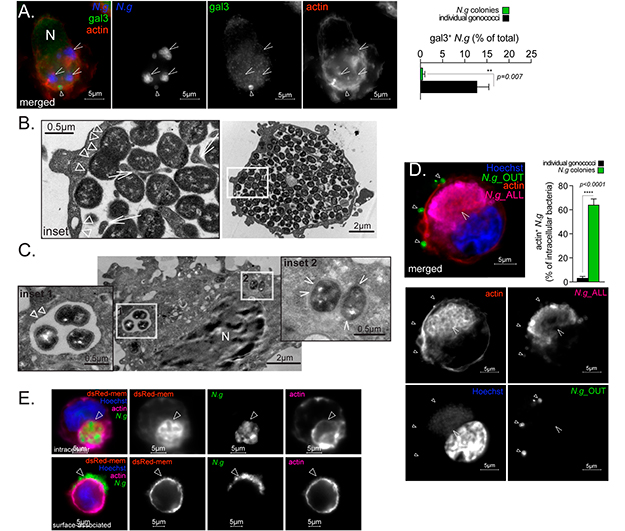
Para obtener información sobre la biogénesis del orgánulo ocupado por gonococos, investigaron la maduración endosómica de los fagosomas que contienen colonias de gonococos. Los fagosomas que contienen diplococos o gonococos muertos por calor, acumularon marcadores endosómicos tempranos (EEA1) y tardíos (Rab7 y LAMP2), a diferencia de las colonias de gonococos internalizados, donde una extensa red de filamentos de actina rodeaba las colonias intracelulares de gonococos dentro de los MF U937 (Figura 6D) y los hMDM primarios.
La red de microfilamentos de actina que comenzó a formarse durante la internalización de la colonia también se conserva alrededor de la mayoría de las colonias intracelulares (Figura 6D). Esta persistencia es inconsistente con la dinámica de la actina durante la fagocitosis, ya que las redes de actina que rodean los endosomas nacientes se deshacen rápidamente. La retención de dsRed-mem en colonias internalizadas (Figura 6E) combinada con la incapacidad de reclutar marcadores endosómicos (Figuras 5A y 5B), indica que la vacuola ocupada por los gonococos evita la fusión con el compartimento endocítico y retiene en cierta medida las características de la membrana plasmática.
La colonización de macrófagos humanos por Neisseria gonorrhoeae tiene lugar a través de un mecanismo mediado por la polimerización de actina dependiente de formina
Con el fin de investigar el mecanismo de internalización de las colonias de Neisseria gonorrhoeae, analizaron farmacológicamente diferentes factores del huésped para identificar los determinantes moleculares de la captación de colonias de Neisseria gonorrohoeae.
La internalización de las colonias se midió utilizando microscopía de adentro hacia afuera en MF U937 a las 8 hpi, lo cual se muestra en la siguiente Figura 7. En controles paralelos, midieron la captación fagocítica de una carga bacteriana viva heteróloga, cultivando MF U937 con bacterias no patógenas de Legionella pneumophila ΔdotA, que se internalizan mediante fagocitosis no específica y se transportan a los lisosomas a través de la vía endosómica en cuestión de minutos. Como se esperaba, la internalización de las colonias de Legionella y Neisseria requirió polimerización de actina (Figura 7A, ActinINH).
La despolimerización de los microtúbulos con nocodazol no afectó la captación de colonias de Neisseria, pero redujo parcialmente la fagocitosis de Legionella (Figura 7A, TubulinINH). De manera similar, las colonias de Neisseria se internalizaron de manera eficiente cuando se inhibió la familia Rho de pequeñas GTPasas, mientras que la fagocitosis de Legionella se redujo significativamente (Figura 7B). La fagocitosis de Legionella por los MF U937 requirió Cdc42 funcional, así como las quinasas efectoras de la GTPasa RhoA ROCK1/2 y LIMK1/2, funciones de Rac1/2/3, PI3K y dinamina; sin embargo, las colonias de gonococos fueron internalizadas de manera eficiente por los MF U937 incluso cuando las GTPasas Rho, PI3K y dinamina fueron inhibidas (Figuras 7B y 7C), lo que demuestra que las colonias de Neisseria gonorrohoeae son internalizadas por los macrófagos a través de un mecanismo dependiente de actina distinto de la fagocitosis canónica.
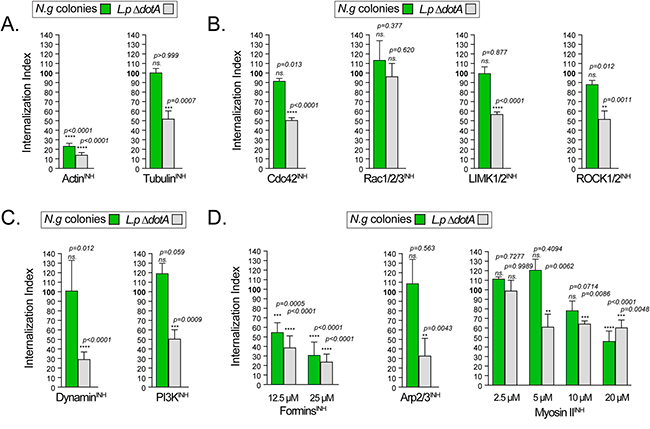
Tres mecanismos nucleadores de actina principales regulan la morfogénesis de la membrana:
- los miembros de la familia de la formina extienden filamentos nucleares lineales;
- el complejo Arp2/3 nuclea filamentos de actina ramificados;
- las ATPasas de miosina II regulan los haces contráctiles de actomiosina.
La captación fagocítica de Legionella dependió de los tres, como se esperaba (Figuras 7D y 7E). Curiosamente, la internalización de colonias de gonococos no se vio afectada por Arp2/3INH (Figura 7D).
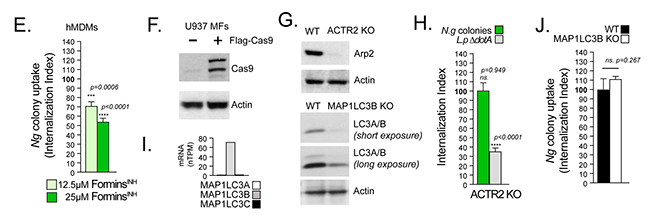
Para confirmar que el complejo Arp2/3 es prescindible para la internalización de colonias de Neisseria, utilizando un enfoque alternativo, utilizaron la edición genómica CRISPR/Cas9 para generar MF U937 en los que el gen ACTR2 que codifica Arp2 está inactivado (Figuras 7F y 7G). Tras esto, a pesar de un defecto general en la fagocitosis causado por la pérdida de Arp2, las MF U937 KO ACTR2 internalizaron colonias de gonococos con la misma eficiencia que la línea celular parental (Figura 7H).
Por otro lado, el tratamiento con el inhibidor de forminas SMIFH2 disminuyó significativamente la captación de colonias de manera dependiente de la dosis en las infecciones por MF U937 (Figura 7D, ForminsINH) y hMDM (Figura 7E).
La miosina IIINH a 5μM logró una reducción máxima en la captación de Legionella, mientras que la internalización de colonias de Neisseria no se vio afectada (Figura 7D). Sin embargo, aumentar la dosis de miosina IIINH a 20μM resultó en un defecto significativo en la captación de colonias de Neisseria, lo que indica que la contractilidad de la actomiosina regula el citoesqueleto de actina durante la internalización de colonias (Figura 7D).
Para determinar si la LC3 LAP o la autofagia canónica regulan la internalización de Neisseria gonorrohoeae, generaron MF U937 KO de MAP1LC3B (Figura 7G), tras comprobar que LC3B es el LC3 principal en los macrófagos MF U937 (Figura 7G). Sin embargo, la inactivación de LC3B no afectó la internalización de colonias de Neisseria (Figura 7J), lo que indica que es poco probable que LAP y la autofagia sean reguladores significativos de este proceso.
Por tanto, los gonococos desencadenan directa o indirectamente un mecanismo de morfogénesis de la membrana plasmática distinto de la fagocitosis canónica, que facilita la invasión de macrófagos a través de la producción de filamentos de actina lineales mediados por uno o más miembros de la familia de las forminas. El comportamiento dinámico de estos filamentos de actina, que da como resultado la internalización de colonias de Neisseria gonorrhoeae, probablemente esté mediado en parte por las fuerzas generadas por las proteínas motoras de miosina.
FMNL3 se localiza en sitios de invasión gonocócica y media la internalización de colonias de Neisseria gonorrohoeae en macrófagos humanos
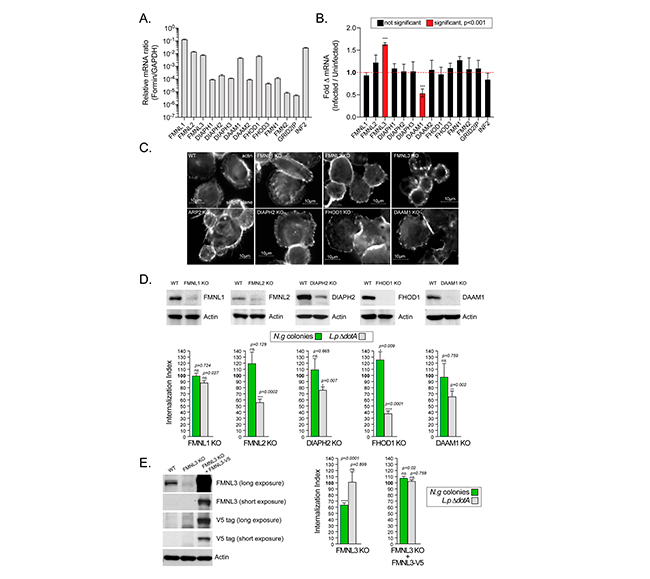
Casi todos los miembros de la familia de nucleadores de actina de forminas, fueron expresados por MF U937 en diversos grados, tal y como se muestra en la siguiente Figura 8A. Los ARNm de FMNL1, FMNL2, FMNL3, DAAM1, FHOD1 e INF2, fueron los expresados de forma más abundante. La infección gonocócica no alteró la abundancia de estos ARNm, con excepción de FMNL3 y DAAM1. A las 4 hpi, la abundancia de ARNm de FMNL3 aumentó en un ~50%, mientras que la de DAAM1 disminuyó en un ~50% (Figura. 8B).
Para determinar qué formina media la invasión gonocócica, utilizaron un enfoque genético para eliminar miembros individuales en células U937 utilizando la edición del genoma CRISPR/Cas9. Las siguientes líneas celulares U937 se generaron y validaron con éxito mediante análisis de inmunotransferencia: FMNL1 KO, FMNL2 KO, FMNL3 KO, DAAM1 KO, FHOD1 KO, DIAPH2 KO (Figuras 8C–8E).
A continuación, compararon la capacidad de estas líneas celulares para fagocitar Legionella e internalizar colonias gonocócicas, con la línea celular parental. Con esto, descubrieron que la pérdida de FMNL2, DAAM1 y DIAPH2 redujo significativamente la fagocitosis en un 45 %, 35 % y 20 % respectivamente, aunque las colonias gonocócicas se internalizaron de manera eficiente (Figura 8D). En ausencia de FHOD1, la fagocitosis se redujo en un 65%, pero el número de colonias gonocócicas internalizadas aumentó significativamente en un 20%. Por el contrario, la pérdida de FMNL3 redujo significativamente la invasión gonocócica en un 40% a pesar de la fagocitosis normal de Legionella (Figura 8E). Estos resultados demuestran que la invasión de macrófagos por gonococos está mediada por FMNL3, una formina que no regula la fagocitosis en los MF U937, mientras que las forminas que afectan la fagocitosis de los macrófagos (FHOD1, FMNL2, DAAM1 y DIAPH2) fueron prescindibles para la internalización de colonias.
Debido a que FMNL3 es necesario para la captación gonocócica, presumiblemente al mediar la polimerización de actina en los sitios de invasión, investigaron si FMNL3 se localizaba allí. Para ello, expresaron ectópicamente FMNL3-V5 en MF U937, el cual se reclutó preferentemente en los sitios de entrada gonocócica, tal y como se muestra en la siguiente Figura 9A, donde la formina se co-localizó ampliamente con la red de filamentos de actina que rodea la colonia invasora (Figura 9B). En contraste, FMN1-V5, otro miembro de la familia de las forminas, no se co-localizó con los filamentos de actina en el sitio de internalización de la colonia de Neisseria (Figuras 9C y 9D). Además, las colonias asociadas a la superficie que no desencadenaron la polimerización de actina, tampoco reclutaron FMNL3-V5 (Figura 9E), lo que indica que los dos procesos coinciden. Es importante destacar que ni la actina ni FMNL3 fueron reclutadas por agregados asociados a la superficie de gonococos muertos por calor (Figuras 9F y 9G), lo que indica que la polimerización de actina mediada por FMNL3 que conduce a la internalización de la colonia, probablemente sea desencadenada directa o indirectamente por las bacterias invasoras.
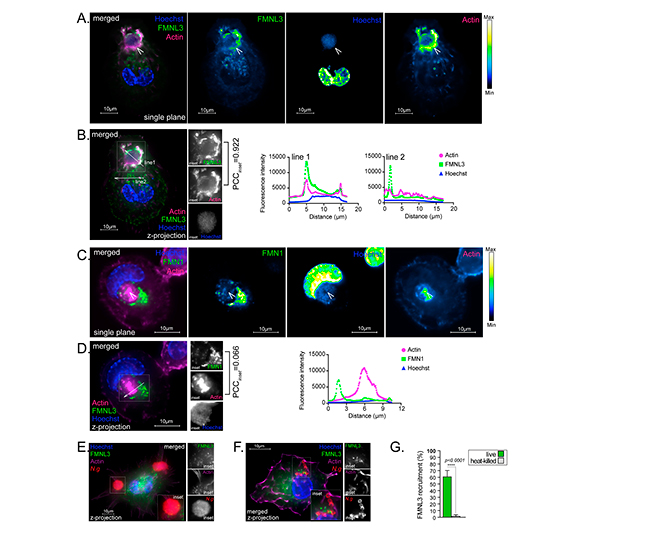
Finalmente, para determinar la relevancia biológica de la captación gonocócica mediada por FMNL3, investigaron si la invasión de macrófagos humanos protege a los gonococos de las actividades microbicidas extracelulares. Con este fin, se permitió que los gonococos invadieran los macrófagos MF U937 durante 6 horas, momento en el que se agregó gentamicina durante 2 horas adicionales para matar las bacterias no internalizadas.
En este ensayo, cuando se bloqueó la invasión con citocalasina D, el número de bacterias protegidas disminuyó en ~90%. Además, la inactivación de FMNL3 también fenocopió el tratamiento con citocalasina D, aunque en menor medida. Por lo tanto, la internalización gonocócica mediada por FMNL3 en macrófagos humanos es beneficiosa para las bacterias en este contexto.
CEACAM1 es prescindible para la invasión de macrófagos humanos por colonias de Neisseria gonorrohoeae
CEACAM1 es un receptor bien establecido para la colonización de Neisseria gonorrohoeae de varios tipos de células, incluidas las células epiteliales y los neutrófilos, que pueden unirse a cierta familia Opa de adhesinas gonocócicas. En las infecciones por neutrófilos, la unión de las proteínas Opa a CEACAM1 o CEACAM3 facilita la internalización, donde la interacción de CEACAM3 transporta los gonococos a un compartimento degradativo y estimula la secreción de citocinas inflamatorias.
Ya que pudieron detectar la expresión de CEACAM1 pero no de CEACAM3 y CEACAM5 en MF U937 por qPCR, determinaron si CEACAM1 actúa aguas arriba de FMNL3 para mediar la invasión de colonias gonocócicas. Con este fin, generaron MF U937 KO CEACAM1 mediante edición del genoma.
Como resultado, la pérdida de CEACAM1 no afectó la fagocitosis de Legionella ni la internalización de colonias gonocócicas por MF U937, lo que demuestra que CEACAM1 es prescindible para la invasión y colonización intracelular de macrófagos humanos por Neisseira gonorrhoeae.
Discusión
En este artículo, se ha demostrado que Neisseria gonorrhoeae coloniza macrófagos humanos estableciendo dos nichos celulares distintos: uno asociado a la superficie y otro intracelular, que pueden sustentar de forma independiente la replicación bacteriana.
Los datos de este trabajo indican que la invasión de macrófagos y el establecimiento de una colonia de gonococos intracelulares, se lleva a cabo por una colonia bacteriana asociada a la superficie. Este nuevo paradigma de colonización, es diferente a otros patógenos bacterianos intracelulares que invaden las células huésped como organismos únicos.
El modelo que proponen define tres etapas distintas de colonización e identifica varios factores reguladores. En la primera etapa (dentro de las 2 horas posteriores al contacto), los colonizadores exitosos se adhirieron a la superficie del macrófago, evadieron la fagocitosis y se dividieron para producir microcolonias. Los colonizadores gonocócicos lograron la persistencia en la superficie mediante la interferencia de la fagocitosis de una manera que permitió la captación de otra carga por los macrófagos colonizados. Proponen que la evasión temprana de la fagocitosis es un paso crítico en la colonización de macrófagos, porque los gonococos que no lograron bloquear la fagocitosis no dieron lugar a colonias intracelulares, sino que fueron transportados a los lisosomas y destruidos.
Después de que se establecen las microcolonias de la superficie (2-6 hpi), el proceso de colonización se ramifica en la segunda etapa, donde la mayoría de las microcolonias comienzan a invadir la célula huésped y el resto permanece asociado a la superficie. La aparición de colonias intracelulares que residen dentro de orgánulos unidos a la membrana, marca la tercera etapa de la colonización. En 24 horas, un porcentaje significativo de colonias gonocócicas eran intracelulares y algunas contenían cientos de bacterias.
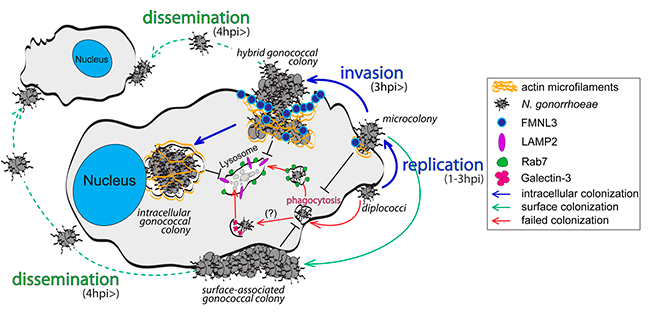
En conjunto, varias líneas de evidencia demuestran que las colonias intracelulares se originaron a partir de microcolonias superficiales que invaden la célula huésped a través de un mecanismo dependiente de actina atípico, en lugar de la fagocitosis de diplococos individuales:
- la colonización intracelular fue independiente de varios reguladores canónicos clave de la fagocitosis: Rho GTPasas, PI3K, dinamina, Arp2/3;
- el complejo Arp2/3fue prescindible para la internalización de la colonia gonocócica;
- la formina FMNL3 fue necesaria para la invasión de Neisseria gonorrohoeae, pero fue prescindible para la fagocitosis en general;
- la eliminación de las forminas reguladoras de la fagocitosis aumentó (FHOD1) o no afectó la invasión de la colonia gonocócica (FMNL2, DIAPH2 y DAAM1);
- los diplococos internalizados se trasladaron al compartimento endolisosomal, mientras que las colonias invasoras excluyeron EEA1, Rab7 y LAMP2;
- la interrupción de la polimerización de actina a las 4 hpi redujo significativamente la colonización intracelular, aunque una gran cantidad de diplococos se internalizaron en cuestión de minutos.
Además, las cuatro cepas de gonococos de origen clínico diferentes que probaron colonizaron MF U937 y MDM humanos primarios de manera similar y produjeron colonias asociadas a la superficie, así como colonias intracelulares con filamentos de actina. Por lo tanto, la colonización gonocócica de MF U937 recapitula, en muchos aspectos, la colonización de los macrófagos humanos primarios derivados de monocitos.
Cabe destacar que la invasión de gonococos requirió FMNL3, pero no sus homólogos cercanos FMNL1 y FMNL2. Los FMNL son miembros de la familia de las forminas de nucleadores de actina que pueden ensamblar y agrupar microfilamentos de actina lineales. En los MF U937, la pérdida de FMNL2, DIAPH2, FHOD1 y DAAM1, pero no de FMNL3, redujo la fagocitosis no específica. Sin embargo, la eliminación de FMNL3 redujo la invasión de colonias gonocócicas, aunque el fenotipo fue menos pronunciado en comparación con el tratamiento con SMIFH2, lo que indica que la captación también podría estar regulada por otras forminas. El efecto fuera del objetivo descubierto recientemente de SMIFH2 (ForminINH) sobre la miosina II podría proporcionar una explicación alternativa para estos resultados, es decir, la inhibición combinada de FMNL3 y miosina II por SMIFH2 mejoraría el fenotipo. No obstante, la invasión gonocócica es significativamente menos sensible a la inhibición de la miosina II en comparación con la fagocitosis no específica, lo que indica que se necesita una alteración extensa de la red de actomiosina para lograr un bloqueo en la internalización gonocócica. Claramente, el papel potencial de los motores de miosina en la invasión gonocócica justifica un mayor análisis.
FMNL3 y F-actina también se acumularon específicamente en las regiones de la membrana plasmática donde se internalizan las colonias de gonococos, lo que no sucedió cuando los agregados de gonococos muertos por calor se adhirieron a los macrófagos, lo que indica que los gonococos podrían desencadenar directa o indirectamente la activación de FMNL3.
Las forminas normalmente se pliegan en un estado autoinhibido y su función está estrechamente regulada en los sitios donde se necesita la polimerización de actina. Cuando se unen a GTP, los miembros de la familia Rho de pequeñas GTPasas pueden unirse a las forminas e interrumpir el estado autoinhibitorio, lo que resulta en la polimerización de actina de una manera controlada espacialmente. Sin embargo, Rac1/2/3, Cdc42, así como las quinasas efectoras Rho LIMK1/2 y ROCK1/2 fueron prescindibles para la captación de colonias de gonococos por macrófagos; por lo tanto, se necesitan más estudios para determinar los eventos previos que conducen a la activación de FMNL3.
Por otro lado, no se ha demostrado que los gonococos proporcionen proteína bacteriana al citosol del huésped, por lo que especulan que la activación de FMNL3 es más probable que esté mediada por la participación de un receptor de superficie celular de macrófagos.
Tanto los gonococos como los meningococos pueden formar colonias epicelulares en las células epiteliales, en las que la base de la colonia está parcialmente incrustada en pliegues de membrana plasmática ricos en actina conocidos como placas de actina, las cuales agrupan varios receptores de superficie para reclutar Ezrin, una proteína adaptadora que enlaza los receptores de superficie celular con la red de actina cortical. Aunque en los macrófagos las colonias de superficie de gonococos no produjeron placas de actina ni reclutaron Ezrin, mecanismos análogos, podrían conducir a la activación de FMNL3.
La captación de gonococos por los neutrófilos está mediada por la interacción de las adhesinas Opa con los receptores de superficie humanos CEACAM1/CEACAM3 y es estrictamente específica de la especie. En este sentido, descubrieron que los MF U937 no expresaban CEACAM3 y que CEACAM1 es prescindible para la entrada en los macrófagos. De manera similar a las infecciones de macrófagos, se encontró que los gonococos eran tanto intracelulares como superficiales en las infecciones de neutrófilos. Por lo tanto, los mecanismos de entrada y subversión de la actina utilizados por los gonococos para la colonización de macrófagos, neutrófilos y células epiteliales parecen distintos, pero comparten algunos principios comunes.
Durante la invasión, la colonia de gonococos se extiende desde la superficie del macrófago hasta una invaginación de la membrana plasmática que alberga una fracción de la colonia. En este contexto, los gonococos de la superficie actuaron como un tapón para sellar la apertura de la invaginación de la membrana, produciendo así un compartimento membranoso cuasi intracelular que está envuelto en microfilamentos de actina polimerizada.
La clara y discreta delimitación observada entre las fracciones protegidas (intracelulares) y desprotegidas (expuestas a la superficie) de la colonia invasora en los estudios de inmunofluorescencia de adentro hacia afuera, demuestra que los gonococos y la membrana plasmática están fuertemente opuestos entre sí en la zona de transición, lo que hace que los gonococos dentro de la invaginación de la membrana estén protegidos de los anticuerpos en el medio extracelular. De hecho, se encontró que los microfilamentos de actina enmarcan a las bacterias en el cuello de la invaginación de la membrana plasmática ocupada por colonias híbridas. Todavía queda por determinar cómo las forminas producen estas invaginaciones de la membrana plasmática. Sin embargo, hasta donde saben, este es el primer ejemplo de un mecanismo de entrada de patógenos bacterianos basado únicamente en microfilamentos de actina lineales que no requiere un complejo Arp2/3 funcional.
Este estudio demuestra que, en las infecciones por macrófagos, los gonococos pueden replicarse intracelularmente dentro de un orgánulo unido a la membrana, así como dentro de una colonia asociada a la membrana plasmática. Se ha informado que los gonococos se localizan en el citosol de las células epiteliales y de los macrófagos, por lo que se ha especulado que la replicación bacteriana tenga lugar en el citosol de estos. Con poca frecuencia, detectaron diplococos individuales en el citosol de los macrófagos infectados. La ruptura del fagosoma que contiene bacterias puede depositar patógenos vacuolares en el citosol del huésped, que posteriormente se eliminan por autofagia. Es posible que el escape citosólico sea un subproducto de un defecto en la entrada, lo que explicaría por qué las bacterias individuales, pero no las colonias de gonococos, se localizan en el citosol. Potencialmente, los macrófagos podrían ser más eficientes en la eliminación autofágica de bacterias citosólicas en comparación con las células epiteliales, evitando así la replicación gonocócica en el citosol.
En conjunto, estos datos destacan que los gonococos probablemente hayan evolucionado para establecer múltiples nichos celulares distintos simultáneamente. Este fenómeno tiene implicaciones obvias en la evasión inmunológica. Un nicho asociado a la superficie protege de una serie de respuestas celulares de defensa autónomas dirigidas a patógenos intracelulares (como la degradación lisosomal, la autofagia y las respuestas de muerte de la célula huésped); mientras que un nicho intracelular protege contra los factores de defensa humorales que se dirigen a las bacterias extracelulares (como el complemento, los anticuerpos circulantes y los péptidos antimicrobianos). Tal vez la adaptación a múltiples nichos topológicamente distintos podría ser una solución evolutiva elegante para contrarrestar múltiples respuestas de defensa inherentemente distintas del huésped, aunque al costo de proteger solo una fracción de la población bacteriana.
Fuente de este artículo
Este artículo fue publicado originalmente en la revista Plos Pathogens bajo la referencia: Ivanov SS, Castore R, Juarez Rodriguez MD, Circu M, Dragoi A-M (2021) Neisseria gonorrhoeae subverts formin-dependent actin polymerization to colonize human macrophages. PLoS Pathog 17(12): e1010184. https://doi.org/10.1371/journal.ppat.1010184; estando disponible con acceso libre en la propia web de Plos Pathogens.


