Este artículo resume todo lo que se sabe acerca de los péptidos marinos anti cáncer, dando detalles sobre su obtención y funcionamiento a la hora de ser empleados contra dicha enfermedad, y concluyendo que se puede investigar más sobre el desarrollo de medicamentos.
Presentación
“Marine peptides as Anticancer Agents: A Remedy to Mankind by Nature” (“Péptidos marinos como agentes anti cáncer: un remedio para la humanidad por la naturaleza”), es un artículo tipo review publicado en la revista “Current Protein Science” y realizado por Beena Negi, Deepak Kimar y Diwan S. Rawat.
En él, los autores revisaron un total 189 publicaciones científicas sobre péptidos marinos anti cáncer para resumir todo lo que se sabe sobre ellos, dando detalles sobre su aislamiento, potencial anti cáncer y mecanismo de acción; concluyendo que mediante la investigación interdisciplinaria y colaborativa junto a los avances técnicos, se puede buscar medicamentos más prometedores y económicos para el tratamiento de esta enfermedad.
En la búsqueda de moléculas bioactivas, la naturaleza siempre ha sido una importante fuente y por ello, la mayoría de medicamentos son de origen natural o derivados de productos naturales.
El océano, por su parte, ha jugado siempre un papel significativo, ya que se han aislado de organismos marinos, miles de moléculas y sus metabolitos con distintos tipos de actividad biológica, tales como anti microbiana, anti inflamatoria, anti malaria, antioxidante, anti VIH y anti cáncer. En concreto, los péptidos marinos han llamado mucho la atención debido a su alta especificidad contra líneas celulares cancerosas, la cual puede ser atribuida a sus diversos e inusuales residuos de aminoácidos y su secuencia en la cadena peptídica.
Hoy en día, el cáncer es una enfermedad importante y causa de muerte tanto en los países desarrollados como en los que no. Ésta se caracteriza por el crecimiento incontrolado de células que se expanden por el cuerpo a través de la linfa o la sangre.
Sin embargo, solo un número limitado de medicamentos anti cáncer está disponible hoy en día. Así pues, en este artículo, los autores pretenden identificar los diversos agentes anti cáncer aislados del medio marino e indicar su potencial contra esta enfermedad.
Métodos y Resultados
El método del trabajo, como dijimos antes, consistió en la revisión de 189 artículos científicos sobre péptidos marinos anti cáncer. A continuación, se explica el aislamiento y el potencial anticancerígeno de esos péptidos marinos, descritos para cada organismo marino fuente de obtención, según se reporta en la bibliografía analizada por los autores de este artículo.
Péptidos marinos de esponjas
Las esponjas marinas son conocidas como una fuente vital de novedosos metabolitos bioactivos, los cuales poseen un amplio rango de actividades biológicas y que ello, son considerados como una “mina de oro” para los químicos.
Hace poco se ha investigado sobre nuevos péptidos marinos bioactivos en estos organismos, los cuales son principalmente péptidos cíclicos o lineales con aminoácidos inusuales y con una condensación poco común entre los aminoácidos.
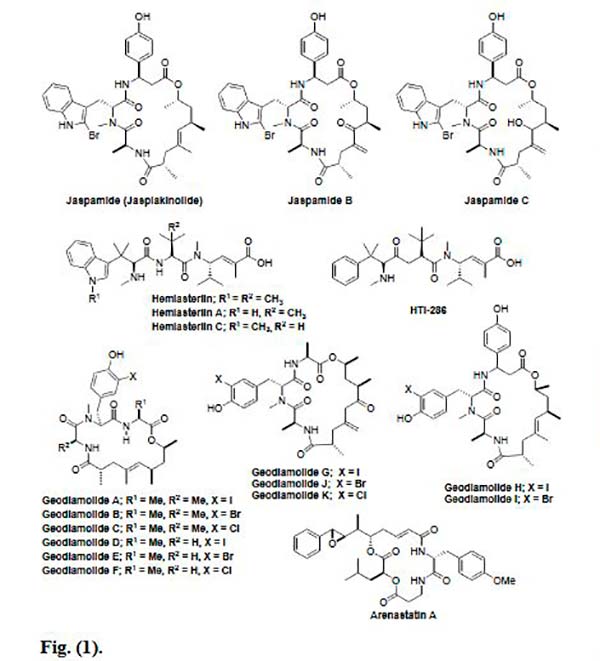
Uno de los péptidos marinos aislado de esponjas es la Jaspamida, la cual es un depsipéptido cíclico aislado de esponjas de los géneros Jaspis y Hemiastrella. Su estructura consiste en un anillo macro cíclico de 15 carbonos que tiene tres residuos de aminoácidos. La Jaspamida tiene una fuerte actividad anti proliferativa contra PC-3, LNCaP y TSU-Pr1 (líneas celulares de carcinoma de próstata humano) y células Jurkat T humanas. Recientemente Cioca et al. también informaron sobre la actividad de apoptosis de Jaspamida en promielocítica humana, línea celular de leucemia y células T en tumor cerebral.

Las Hemiasterlinas son tripéptidos aislados de dos especies distintas de esponja: Auletta y Siphonochalina sp. Hay tres Hemiasterlinas diferentes (Hemiasterlina, Hemiasterlina A y Hemiasterlina C) con potencial actividad citotóxica y antitubulina que provoca muerte celular. Cabe indicar que también se ha sintetizado un análogo sintético de estos péptidos marinos, la Taltobulina.

Las Geodiamolidas A-G son péptidos marinos cíclicos aislados de la esponja del Caribe Geodia sp. También la Geodiamolida H mostró citotoxicidad in vitro frente a diversas líneas de células cancerosas humanas, como cáncer de pulmón de células no pequeñas, sistema nervioso central, cáncer de ovario y cáncer de mama. Freitas et al. investigaron los efectos de ésta, viendo que disminuye significativamente la migración y la invasión de células cancerígenas.

La Arenastatina A es un ciclodepsipéptido que se aisló de la esponja marina Dysidia arenaria y que mostró una citotoxicidad extremadamente potente. Sin embargo, se descubrió que este péptido marino exhibía actividad antitumoral débil in vivo, la cual podría atribuirse al metabolismo rápido del enlace 15,20 éster. Para superar este problema, se sintetizaron varios análogos de 15,20-triamida con un sustituyente polar en el anillo de fenilo, los cuales se encontraron como compuestos citotóxicos más potentes, con buena solubilidad y estabilidad.

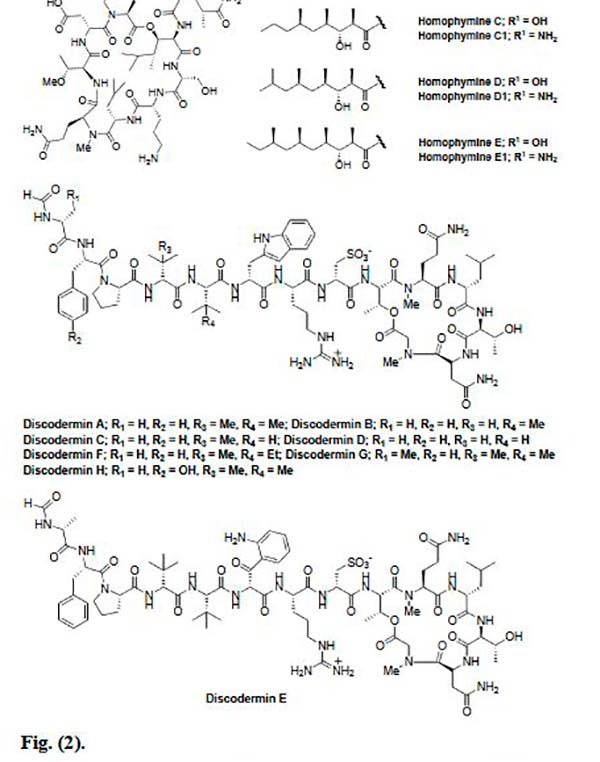
Las Homophymines B-E y A1-E1 también son ciclodepsipéptidos, pero aislados, en este caso, de la esponja Homophymia sp, las cuales mostraron actividad anticancerosa altamente potente contra varias líneas de células cancerosas en el rango nano molar. Cabe indicar que las Homophymines A1-E1 que tienen el resto del ácido 4-amino-6-carbamoil-2,3-dihidroxihexanoico, mostraron una mejor actividad que las Homophymines A-E correspondientes, que consisten en el mismo resto en su forma carboxi. Sin embargo, estos péptidos marinos exhiben una actividad tóxica en lugar de anti proliferativa.

Los péptidos marinos Discoderminas A-H, se obtuvieron a partir de esponjas del género Discodermia sp. Estos compuestos contienen algunos aminoácidos raros en la cadena, mientras que el anillo macro cíclico presente en la estructura, se forma por la lactonización del aminoácido, treonina con el terminal carboxi. Las Discoderminas F, G y H fueron citotóxicas contra las células de la leucemia P388 con valores IC50 de 0.1, 0.4 y 0.1 μg/mL, respectivamente.

La Phakellistatin 1 es un heptapéptido cíclico que fue aislado de dos esponjas del océano Indo-Pacífico, Phakellia costata y Stylotella aurantium, y que mostró actividad inhibidora del crecimiento contra la leucemia murina (P-388) con un valor ED50 de 7.5μg/mL.
Dos nuevos miembros del grupo de la Phakellistatin, Phakellistatin 2 y Phakellistatin 3, fueron aislados de la esponja marina Phakellia carteri por Pettit y colaboradores. Éstas mostraron un crecimiento inhibidor contra la línea celular P-388 con un valor ED50 de 0,34 y 0,33μg/mL, respectivamente. Además, Phakellistatin 2 también mostró buena actividad contra líneas celulares ováricas, cerebrales, renales, pulmonares, colon y melanoma, con valores log10 GI50 de 1.0, 3.0, 2.1, 2.0, 2.8, 1.0μg /mL, respectivamente. Asimismo, Pettit et al. también aislaron tres nuevos congéneres, Phakellistatin 4, 5 y 6 de Phakellia costata. Phakellistatin 6 mostró un buen nivel de inhibición del crecimiento de las células cancerosas frente a la leucemia linfocítica P388 murina, así como también en las líneas celulares de cáncer ovárico, SNC, renal, pulmonar, de colon y melanoma.

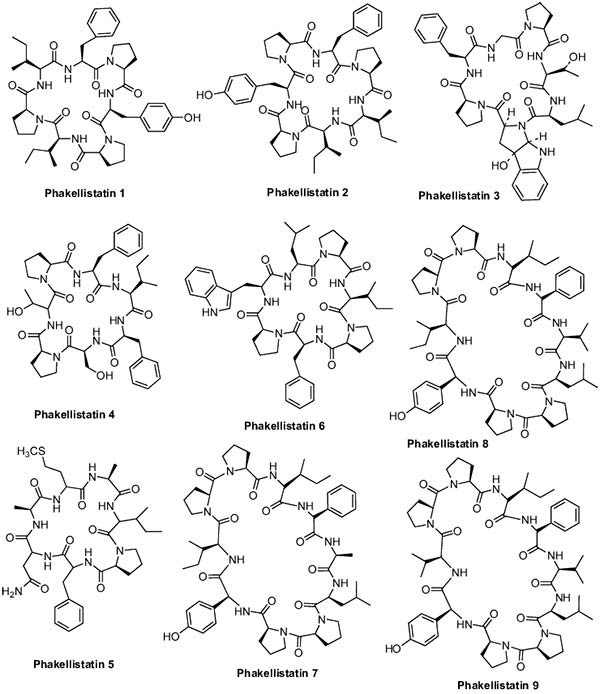
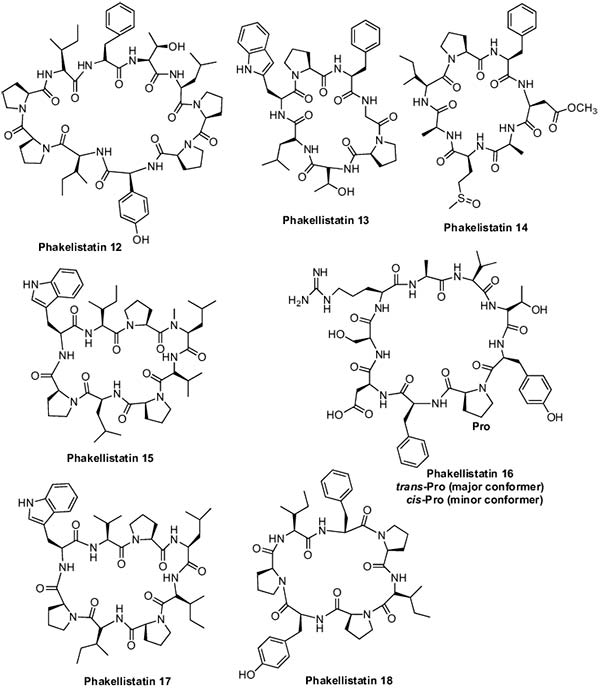
Continuando con las Phakellistatins, las Phakellistatin 10-14 se aislaron de la esponja Phakellia fusca. Phakellistatin 10, Phakellistatin 11 y 12, inhibieron el crecimiento de la leucemia linfocítica P-388 murina con valores ED50 de 2,1, 0,20 y 2,8μg /ml, respectivamente. Phakellistatin 13, por su parte, mostró una fuerte actividad citotóxica contra la línea celular de hepatoma humano BEL-7404 con una DE50 <10-2μg/mlL Phakellistatin 14 mostró actividad inhibidora del crecimiento de células cancerígenas (ED50 = 5μg/mL) frente a la línea celular de leucemia linfocítica P388 murina y un panel de células cancerosas humanas (GI50 = 0,75-3,4 μg/mL). La Phakellistatin 15 exhibió citotoxicidad contra la línea celular de cáncer P388 con un valor de CI50 de 8,5μM, mientras que la Phakellistatin 16 mostró también citotoxicidad contra las líneas celulares de cáncer P388 y BEL-7402 con valores IC50 de 5,4 y 14,3μM, respectivamente.

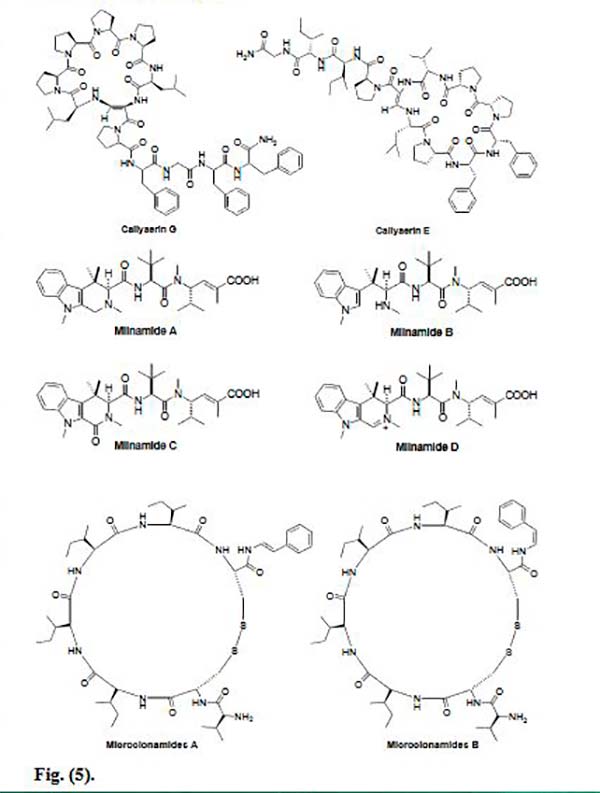
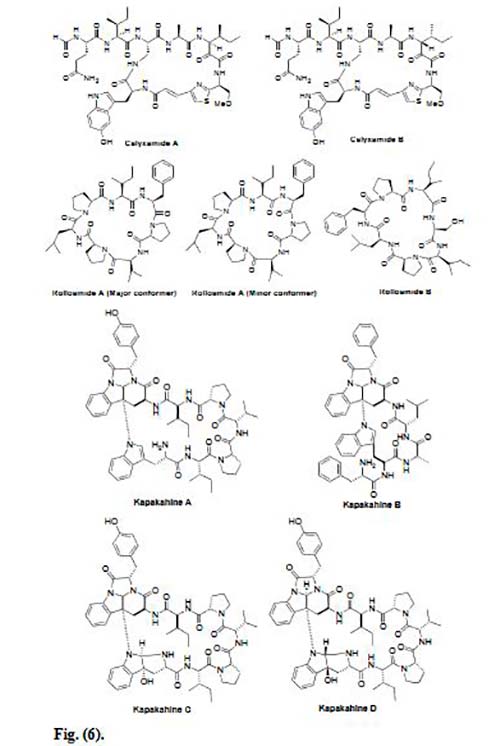
La Callyaerina G es un péptido marino cíclico aislado de la esponja indonesia Callyspongia aerizusa. Las Calleyerinas albergan un sistema peptídico cíclico de 5-9 aminoácidos junto con una cadena lateral que contiene 2-5 residuos de aminoácidos Se descubrió que es citotóxica para la línea celular de linfoma de ratón (L5178Y) y células de carcinoma de cuello uterino humano (HeLa) con ED50 de 0,53 y 5,4μg/mL, respectivamente.
Recientemente, Ibrahim et al. han aislado nuevos péptidos marinos cíclicos, Callyaerinas A-F y H de la misma esponja. Las Calleyerinas E y H mostraron una potente actividad hacia la línea celular L5178Y con valores ED50 de 0,39 y 0,48μM, respectivamente, mientras que los compuestos restantes fueron menos activos hacia esta línea celular, excepto la Callyaerina F, la cual se vio que era totalmente inactiva. Entre todas las Callyaerinas, la Callyaerina E fue el compuesto más activo. La relación estructura-actividad de este compuesto, indica que aumentar el número de restos de prolina en el resto cíclico, aumenta la actividad anticancerígena, y el reemplazo de un resto de prolina por una hidroxiprolina, reduce la actividad anticancerígena.

La Miliamida A es un tripéptido citotóxico que se aisló en Papua Nueva Guinea de la esponja Axinellida Auletta cf. constricta. Este péptido marino muestra una actividad citotóxica significativa contra varias líneas celulares cancerosas. Una reinvestigación de la esponja Auletta sp. permitió obtener un compuesto relacionado, la Miliamida C, junto con los compuestos ya Miliamida A y Miliamida B (hemiasterlina). Las Miliamida B y C se evaluaron por su citotoxicidad frente a las células cancerosas MDA-MB-435 y exhibieron valores de CI50 de 0,15ng /ml y 0,32μg /ml, respectivamente. Por otro lado, la esponja Cymbastela recolectada en Milne Bay, Papua Nueva Guinea, proporcionó la Miliamida D junto con la ya conocida Miliamida A. Ambas se analizaron contra dos líneas celulares de cáncer colorrectal, donde la Miliamida D (IC50 = 66.8 nM) fue significativamente más potente que la Miliamida A (IC50 = 1652.6 nM).


Dos nuevos péptidos marinos anti cáncer, Microcionamides A y B, se aislaron de la esponja filipina Clathria (Thalysias) abietina. Éstos mostraron citotoxicidad significativa hacia las líneas celulares de tumor de mama humano MCF-7 y SKBR-3. La Microcionamida A fue activa contra células MCF-7 y SKBR-3 con valores IC50 de 125 y 98nM, respectivamente, mientras que la Microcionamida B mostró actividad con valores IC50 de 177 y 172nM, respectivamente. Además, se demostró que ambos compuestos inducen apoptosis dentro de las 24h en células MCF-7 a una concentración de 5.7μM.

Las Calyxamidas A y B se aislaron de la esponja marina Discodermia calyx recogida cerca de la isla Shikine-jima (Japón), las cuales son los primeros péptidos aislados de dicha esponja y que contienen restos de 5-hidroxitriptófano y tiazol. Las Calyxamidas A y B mostraron una citotoxicidad moderada contra las células de leucemia murina P388, con valores de IC50 de 3.9 y 0.9μM, respectivamente.

Williams et al. aislaron dos heptapéptidos cíclicos, las Rolloamidas A y B, de la esponja marina dominicana Eurypon laughlini. La Rolloamida A exhibió una actividad significativa de supresión del crecimiento frente a un panel de líneas celulares cancerosas histológicamente diversas, con valores de CI50 que varían de 0,17 a 5,8μM.

Cuatro péptidos marinos cíclicos, Kapakahines A-D, se aislaron de la esponja marina Cribrochalina olemda. Estos péptidos carecen de un enlace amida entre dos restos de triptófano y el anillo se cierra mediante un enlace del nitrógeno indol de Trp-1 al carbono β de Trp-2. Las Kapakahines A, B y C mostraron citotoxicidad moderada contra las células de leucemia murina P388 a valores IC50 de 5,4, 5,0 y 5,0μg /ml, respectivamente, mientras que la Kapakahine D no mostró citotoxicidad hasta una concentración de 10μg/mL.
Una esponja marina del género Theonella recolectada del sudoeste de Japón, produjo un decapéptido lineal, Koshikamida A1, que exhibía actividad citotóxica contra células de leucemia P388, con un valor de CI50 de 2,2μg/mL. La eliminación selectiva del extracto de la misma esponja proporcionó un compuesto estrechamente relacionado, la Koshikamida A2, la cual se identificó como un undecapéptido lineal mediante métodos espectroscópicos y mostró una actividad citotóxica moderada contra las células de leucemia P388 con un valor de CI50 de 6,7μg/mL. Y también de esta esponja, se aisló la Koshikamide B, la cual mostró actividad anticancerígena contra las células de leucemia murina (P388) y la línea celular de tumor de colon humano (HCT-116), con valores de CI50 de 0,45 y 7,5μg/mL, respectivamente.

Finalmente, se aisló un nuevo péptido marino cíclico, Scleritodermin A, de la esponja marina Scleritoderma nodosum, el cual demostró citotoxicidad in vitro frente a un panel de líneas celulares tumorales humanas (IC50 <2μM), que incluyen el carcinoma de colon HCT116, el carcinoma de ovario A2780 y el carcinoma de mama SKBR3.
Péptidos marinos de ascidias
Un número considerable de péptidos marinos cíclicos y lineares, así como depsipéptidos con novedosas características estructurales, también han sido descubiertos en ascidias, generalmente denominadas tunicados.
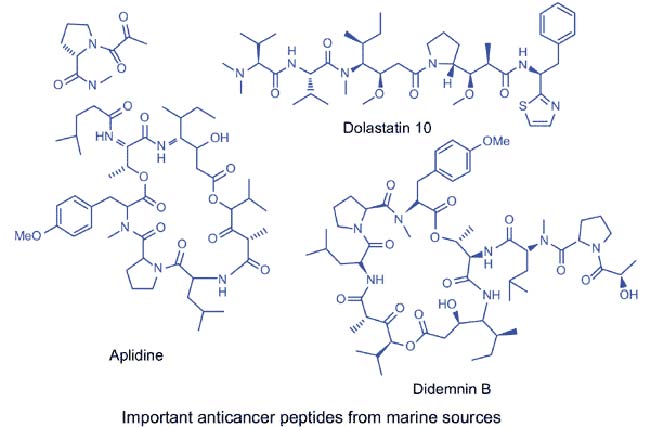
Una de las clases más importantes de depsipéptidos cíclicos aislados del tunicado caribeño Trididemnun solidum son las Didemninas. Hasta hoy, se han obtenido muchos miembros nuevos de péptidos de esta familia, así como una gran cantidad de análogos de Didemninas elaborados sintéticamente o semi sintéticamente y evaluados por su actividad citotóxica.
La Didemnina B junto con otros compuestos anti cáncer de origen marino, fueron examinados contra líneas celulares de cáncer de próstata humano, donde se encontró que la Didemnina B era el agente inhibidor más eficaz en la proliferación de células de cáncer de próstata a niveles de concentración entre 5 y 50 pmol/mL. Además, en el estudio preclínico, se observó que ésta exhibía una potente actividad anticancerígena dependiendo de la dosis, y una toxicidad tolerable que aseguraba que este compuesto fuera evaluado en ensayos clínicos de fase I, siendo así el primer compuesto de una fuente marina que entró en los ensayos clínicos para enfermedades humanas. Desafortunadamente, los ensayos de fase II de la Didemnina B mostraron una eficacia deficiente a las dosis recomendadas y un nivel relativamente más alto de toxicidad, por lo que el Instituto Nacional del Cáncer dio por terminados los ensayos. Sin embargo, la experiencia adquirida en el estudio realizado con Didemnina B ayudó a diseñar nuevas moléculas, lo que ha resultado en el descubrimiento de la potente molécula relacionada Aplidina.

La Aplidina (deshidrodidemnina B) se obtuvo del tunicado mediterráneo, Aplidium albicans. Este péptido marino exhibió una potente actividad citotóxica contra diversas líneas celulares de cáncer humano, tales como cánceres de pulmón, mama y melanoma. Además, la Aplidina resultó ser más activa en comparación con la Didemnina, así como también se vio que la Aplidina se tolera bien, con toxicidad insignificante y algunos efectos secundarios como náuseas, astenia, vómitos y reacciones de hipersensibilidad, pero no toxicidad hematológica ni alopecia. Los estudios clínicos de fase II están en curso para la tiroides renal, de cabeza y cuello y la tiroidea medular en Europa y Canadá. En cuanto a su actuación, hay que destacar que la Aplidina inhibe la enzima ornitina descarboxilasa, que se considera una enzima importante en la formación y crecimiento de células tumorales, entre otras actuaciones que se citan en el artículo.

Vervoort et al. informaron sobre el aislamiento de dos nuevos depsipeptidos citotóxicos, las Tamandarinas A y B, obtenidos de una ascidia marina de la familia Didemnidae. La Tamandarina fue probada por su actividad citotóxica hacia tres líneas celulares de cáncer: el carcinoma pancreático BX-PC3, el carcinoma de próstata DU145 y el carcinoma de cabeza y cuello UMSCC10b; donde la Tamandarina A mostró una reducción del 50% en la supervivencia celular global (IC50) a una concentración de 1.79, 1.36 y 0.99 ng/mL, respectivamente.

Por otra parte, se aisló un nuevo heptapéptido cíclico citotóxico, denominado Mollamida, de la ascidia Didemnum molle. Este péptido marino mostró actividad anticancerígena contra una variedad de líneas celulares cancerosas, como el carcinoma de pulmón humano y el carcinoma de colon humano. Además, la Mollamida fue activa contra P388 (leucemia murina) con un valor IC50 de 1μg/ml y contra las líneas celulares A549 (carcinoma de pulmón humano), HT29 (carcinoma de colon humano) y CV1 (fibroblastos de riñón de mono), con IC50 de 2.5 μg/mL.
También se aislaron dos nuevas Mollamidas, B y C. La Mollamida B se ensayó frente a cuatro líneas celulares de cáncer: la línea celular de cáncer de pulmón de células no pequeñas H460, cáncer de mama MCF7 y cáncer CNS SF-268 a 100μM; donde mostró un porcentaje significativo de inhibición del crecimiento, y se evaluó adicionalmente en el panel de 60 líneas celulares por el National Cancer Institute (NCI). Al mismo tiempo, también se probó la Mollamida C contra dos leucemias, cinco tumores sólidos y una célula normal murina y humana, en un ensayo de difusión en disco.

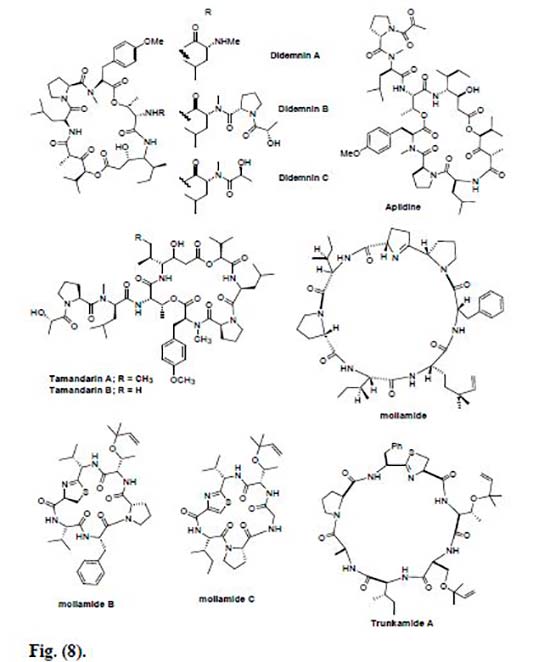
Las Lissoclinamidas, por su parte, comprenden la otra familia a destacar de péptidos marinos cíclicos, las cuales son aisladas de la ascidia Lissoclinum patella. Éste péptido muestra propiedades anticancerígenas significativas, así como otras propiedades farmacológicas contra fibroblastos humanos y líneas celulares de carcinoma de vejiga y linfocitos normales.
Ireland et al. aislaron e informaron de la actividad citotóxica de las Lissoclinamidas 1-3 que mostraron una citotoxicidad moderada contra las células L1210 con valores IC50> 10 pg/mL. Posteriormente, la investigación adicional de Lissoclinum patella produjo dos nuevas Lissoclinamidas, 4 y 5. La Lissoclinamida 4 redujo la supervivencia en células T24 y MRC5CV1 a aproximadamente 5% de los valores no tratados, a 5pg /ml (IC50 = 0,8 μg/mL). Curiosamente, la Lissoclinamida 5, que difiere de Lissoclinamida 4 solo por la presencia de un anillo de tiazol en lugar de tiazolina, es mucho menos citotóxica.
Hawkins et al. también aislaron dos nuevas Lissoclinamidas de la misma especie, las Lissoclinamides 7 y 8. La citotoxicidad de estos compuestos se probó frente a células de carcinoma de vejiga (T24), fibroblastos transformados con SV40 (MRC5CV1) y linfocitos normales de sangre periférica; donde la Lissoclinamida 7 exhibió una actividad muy potente con valores de IC50 de 0.06, 0.04 y 0.08 μg/mL contra (T24), fibroblastos transformados con SV40 (MRC5CV1) y linfocitos, respectivamente; mientras que la Lissoclinamida 8, mostró valores de actividad IC50 de 6, 1 y 8μg/mL, respectivamente.

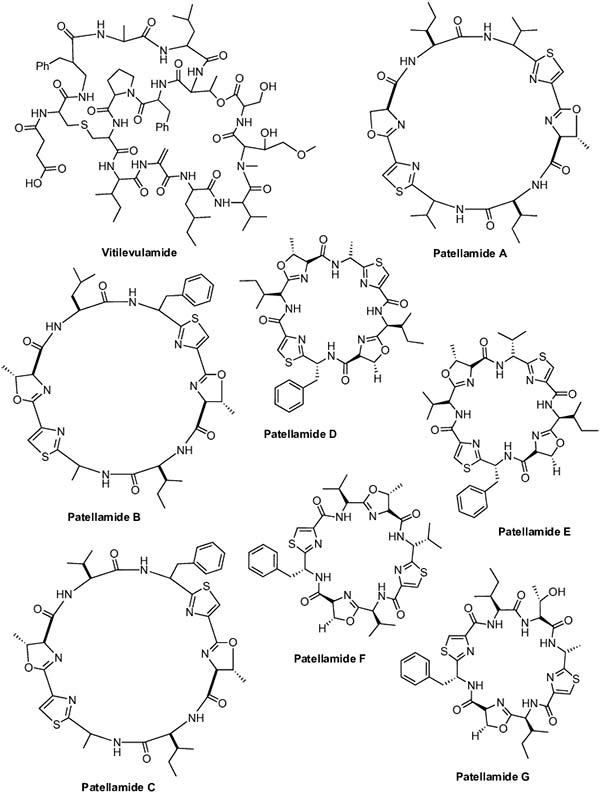
La Vitilevuamida es un péptido bicíclico que fue aislado de dos ascidias marinas, Didemnum cuculiferum y Polysyncranton lithostrotum. Este péptido marino mostró actividad citotóxica en varias líneas de células tumorales humanas con valores de CL50 que varían de 6 a 311nM. Además, in vivo, muestra una actividad contra la leucemia linfocítica P388 que aumenta la esperanza de vida de los ratones leucémicos en un 70%.

Finalmente, tres péptidos marinos cíclicos, Patellamidas A-C, se aislaron de la rótula de Lissoclinum recogida en la Isla Eil Malk, Islas Palaos. Las Patellamidas A, B y C exhibieron actividad aproximadamente igual contra células de leucemia murina L1210, con valores de IC50 de 3.9, 2.0 y 3.2 μg/mL, respectivamente. Además, la Patellamida A también inhibió la CEM de células humanas TOD (leucemia aguda de células T) con valores de CI50 de 0,028 μg/mL.
Asimismo, también se aislaron Patellamide D, E y F de la ascidia Lissoclinum patella. En concreto, la Patellamida D mostró una citotoxicidad marginal contra las células de leucemia linfocítica (PS) con un valor ED50 de 11μg/mL; la Patellamida E fue débilmente citotóxica (CI50 = 125μg/mL) frente a células tumorales de colon humano in vitro; y la Patellamida F mostró un valor de CL50 de 13μM en el panel de línea de células tumorales humanas NCI 60. La investigación adicional de los extractos de Lissoclinum patella, produjo un nuevo análogo, la Patellamida G. Todos los compuestos se evaluaron en cuanto a actividad anti-MDR frente a linfoblastos leucémicos humanos CCRF-CEM resistentes a vinblastina, donde las Paterllamidas B y C redujeron la resistencia a los medicamentos aproximadamente ocho veces.
Péptidos marinos de moluscos
Se han encontrado y aislado varios péptidos marinos citotóxicos cíclicos de moluscos, como las Dolastatinas y las Khalalidas, entre otros. A continuación se habla de ellos con mayor detalle.
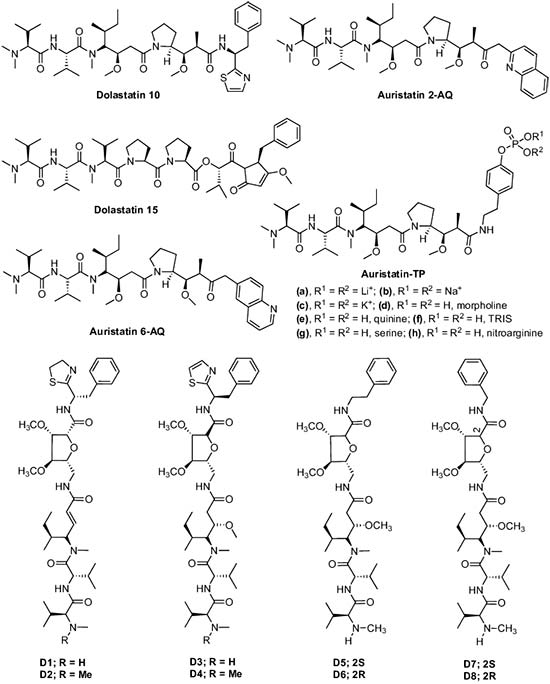
Las Dolastatinas son un grupo de péptidos marinos cíclicos y lineales aislados del molusco marino Dolabella auricularia. En 1981, Pettit et al. aislaron una serie de estos compuestos, Dolastatin 1-9 de dicho molusco. Todos estos compuestos mostraron una actividad anticancerígena muy prometedora, siendo Dolastatina 1 el más activo. Se encontró que éste causaba una extensión de vida del 88% (a una dosis de 11μg/kg) contra la leucemia linfocítica P388 murina y que proporcionaba una respuesta curativa (33%) con una dosis de 11μg/kg contra el melanoma B16 murino.
A partir de entonces, un análogo nuevo y excepcionalmente potente, Dolastatina 10 se aisló también de Dolabella auricularia, el cual era el compuesto antineoplásico más activo hasta la fecha y se vio que mostraba una respuesta curativa del 17-67% a 3,25-26 μg/kg contra el xenógrafo de melanoma humano NCI (ratón desnudo), una extensión de vida del 38% a 1,44-11,1μg/Kg usando el melanoma B16, y una extensión de vida del 69-102% a 1-4 μg/kg frente a la leucemia PS (DE50 de 4,6 × 10-5μg/mL). Debido a su buen perfil de actividad preclínica, se seleccionó la Dolastatina 10 para los ensayos clínicos de fase I. Bai et al. informaron que la Dolastatina 10 inhibe el crecimiento de las células leucémicas murinas L1210 e induce la apoptosis asociada con una disminución en el nivel de Bcl-2 y un aumento en la expresión de p53 en la línea celular de linfoma.
Más tarde, se aislaron muchos análogos del mismo molusco. La mayoría de los compuestos de esta serie inhiben la proliferación celular e inducen la apoptosis en diversas líneas celulares malignas y cancerosas. Por ejemplo, Pettit et al. sintetizaron la Auristatina TP. Cada una de las nuevas Auristatinas mostró una inhibición muy fuerte del crecimiento de células cancerígenas contra un panel de líneas celulares de cáncer murinas y humanas. Así como también Gajula et al. sintetizaron ocho análogos (D1-D8) de Dolastatina 10 que contienen varias subunidades de aminoácidos únicas.
Estos ocho compuestos inhibieron la proliferación de las líneas celulares HeLa, pero los compuestos D1, D2, D3 y D5 resultaron más activos con valores IC50 de 8.7 ± 0.3, 8.8 ± 0.3, 9.9 ± 0.4 y 6.8 ± 0.2nM, respectivamente.

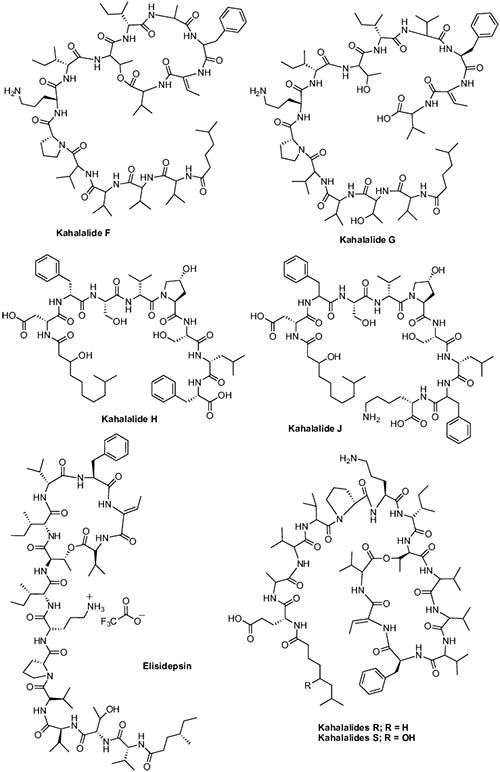
Por otra parte, varias Kahalalidas fueron aisladas del molusco sacoglossa Elysia rufescens, donde las Kahalalidas A-F se obtuvieron de dicho molusco, mientras que la Kahalalide G se aisló de la dieta del animal, un alga verde Bryopsis sp. Además, el análisis adicional del extracto del molusco, descubrió dos nuevos péptidos marinos acíclicos, Kahalalida H y Kahalalida J. Hay que destacar que la Kahalalida F fue el péptido más activo de la serie y mostró un buen nivel de actividad contra A-549, HT-29, LOVO, P-388 y KB, con valores de IC50 de 2.5, 0.25, <1.0, 10 y >10μg/mL, respectivamente.


En 2006, se aislaron dos nuevos análogos de Kahalalida, las Kahalalidas R y S, los cuales se examinaron para determinar su citotoxicidad para líneas celulares de cáncer L1578Y, HeLa y PC12. Se encontró que la Kahalalida R ejerce una citotoxicidad comparable o incluso mayor que la Kahalalida F contra la línea celular de carcinoma de mama humano MCF7. Tanto Kahalalida F como R, mostraron actividad citotóxica comparable hacia células MCF7 con valores de IC50 de 0.22 y 0.14μmol/L, respectivamente; mientras que la Kahalalida S fue menos citotóxica en las líneas celulares MCF7, con un valor de CI50 de 3,55 μmol/L.
Rocha et al. examinaron el modo de acción de Kahalalida F y vieron que interactuaba con los lisosomas celulares que podrían conducir a la acidificación intracelular y la muerte celular. Estos resultados sugirieron que las células con alta actividad lisosómica, como las células de cáncer de próstata, probablemente serían células cancerosas adecuadas para explorar la actividad de este péptido marino.
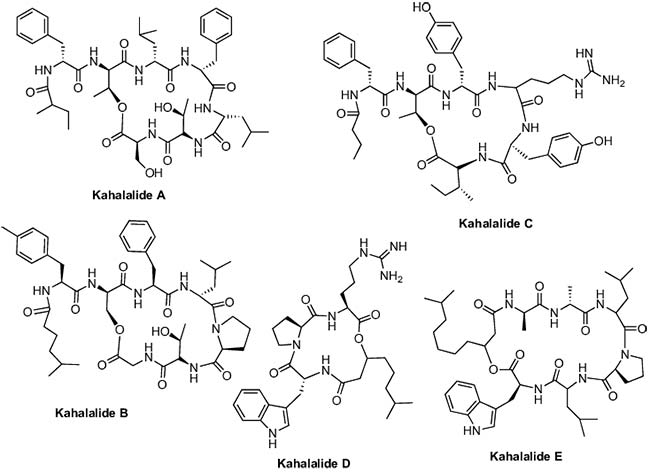
La Kahalalida F recibió licencia de PharmaMar de la Universidad de Hawai en la década de 1990, y se realizaron estudios preclínicos con él. Al completar con éxito dichos estudios en diciembre de 2000, este compuesto ingresó en ensayos clínicos de fase I en Europa para el tratamiento del cáncer de próstata andrógeno-independiente. La Kahalalida F exhibió un buen perfil de actividad y baja toxicidad con pocos efectos secundarios tales como fatiga, dolor de cabeza, vómitos, etc. en estudios de ensayos clínicos de fase I, por lo que los resultados muestran resultados prometedores en ensayos clínicos de fase I solos o con otros agentes anticancerosos y no mostraron toxicidad hematológica, lo que sugiere su utilización en ensayos clínicos adicionales como un agente único o en combinación.
Actualmente, este compuesto se está sometiendo a ensayos clínicos de fase II para el tratamiento de cánceres de pulmón y próstata y melanoma. Además de este compuesto, también se están realizando ensayos clínicos de fase I y II con Elidepsina (PM2734), la cual es un péptido cíclico sintético derivado de la familia Kahalalida F. La Elidepsina destaca por ser un potente agente citotóxico, tanto in vitro como in vivo, en líneas celulares de cáncer de pulmón no microcítico humano (NSCLC).
Péptidos marinos de cianobacterias
Las cianobacterias también han sido una fuente de péptidos marinos bioactivos. Los compuestos aislados de éstas han sido ampliamente estudiados por sus efectos citotóxicos.
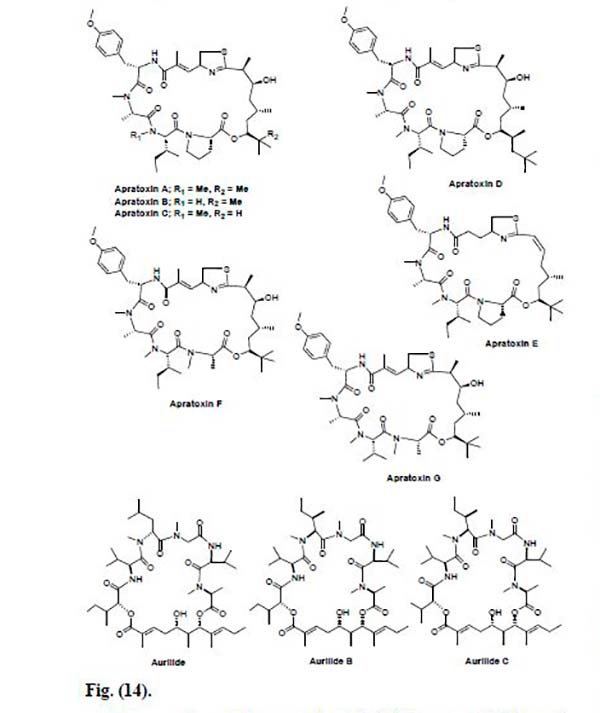
Así pues, Leusch y Moore et al. aislaron un nuevo ciclodepsipéptido, la Apratoxina A de la cianobacteria marina Lyngbya majuscula. Este compuesto mostró una actividad citotóxica muy prometedora contra las líneas celulares de cáncer LoVo y KB con valores IC50 de 0,36 y 0,52nm, respectivamente. Sin embargo, fue moderadamente activo in vivo contra un tumor de colon e ineficaz contra un tumor mamario. El análisis biológico reveló que la Apratoxina A inhibe la proliferación celular al causar el paro del ciclo celular en la fase G1.

En 2008, también se obtuvo la Apratoxina D a partir de extractos de las cianobacterias marinas de Papua Nueva Guinea Lyngbya majuscula y Lyngbya sordid; la cual mostró una potente actividad citotóxica in vitro contra células de cáncer de pulmón humano H-460 con un valor IC50 de 2.6nM.
Una nueva clase de citrato de Apratoxina, la Apratoxina E, se obtuvo de la cianobacteria marina Lyngbya bouillonii de Guam. Ésta mostró una fuerte actividad citotóxica contra varias líneas celulares de cáncer tales como el adenocarcinoma de colon HT29, el carcinoma cervical HeLa y las células de osteosarcoma U2OS con un valor de IC50 de 21, 72 y 59nM, respectivamente.
Asimismo, en 2010, se aislaron dos análogos nuevos y muy potentes, la Apratoxina F y G, las cuales se probaron contra líneas celulares de cáncer H-460 y HCT-116, donde se observó un valor de IC50 de 2 y 14nm para la Apratoxina F contra H-460, y un valor de IC50 de 36,7nm contra la línea celular de cáncer HCT-116 para la Apratoxina G.

Por otra parte, de la misma cianobacteria Lyngbya majuscula, también se aislaron los péptidos marinos Aurilidas B y C, las cuales mostraron citotoxicidad in vitro hacia el tumor de pulmón humano NCI-H460 y las líneas celulares de neuroblastoma de ratón neuro-2a. Cabe indicar que la Aurilida B fue aproximadamente 4 veces más activa que la Aurilida C frente estas líneas celulares. Sobre la base de estos resultados, la Aurilida B se evaluó adicionalmente en el panel de línea celular NCI 60 y se encontró que posee un alto nivel de citotoxicidad (concentración media del panel GI50<10nM) y que es particularmente activa contra líneas celulares de cáncer de leucemia, renal y de próstata.
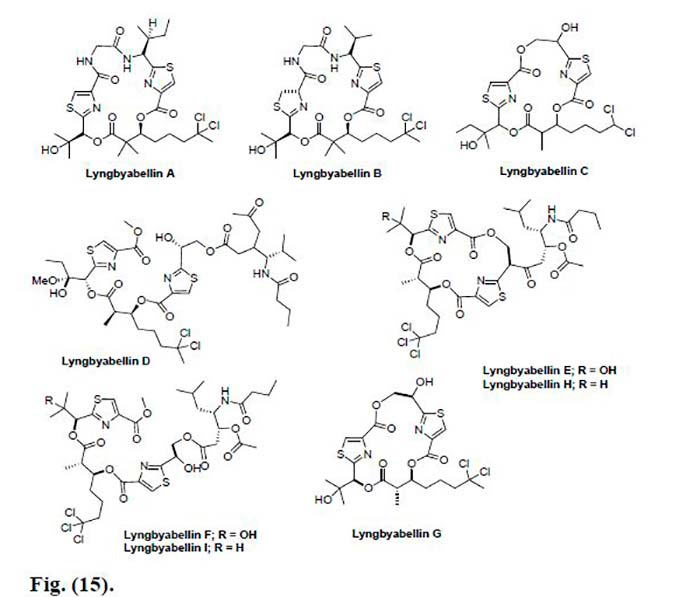
Así como también se aisló la Lynbyabellin A, la cual mostró citotoxicidad moderada contra las células KB (una línea celular de carcinoma nasofaríngeo humano) y las células LoVo (una línea celular de adenocarcinoma de colon humano), con valores IC50 de 0,03 y 0,50 μg/mL, respectivamente. Sin embargo, al probar el sistema in vivo, se descubrió que era tóxico para los ratones. También se aisló Lyngbyabellin B de Lyngbya majuscula recogida en el puerto de Apra, Guam y cerca del Parque Nacional Dry Tortugas, Florida, la cual es ligeramente menos citotóxica in vitro que la Lyngbyabellin A con valores de CI50 de 0,10 y 0,83μg/mL contra las células KB y LoVo, respectivamente.
Asimismo, dos nuevos análogos, Lyngbyabellin C y Lyngbyabellin D fueron aislados de la cianobacteria Lyngbya sp. La Lyngbyabellin C exhibió valores IC50 de 2.1μM contra KB y 5.3μM contra células LoVo, mientras que la Lyngbyabellin D mostró un valor IC50 de 0.1μM frente a la línea celular KB. Además, también se aislaron otros cinco nuevos análogos, Lyngbyabellinas E-I, que mostraron citotoxicidad para el tumor de pulmón humano NCIH460 y las líneas celulares de neuroblastoma de ratón neuro-2a con valores de CL50 entre 0.2 y 4.8μM. Se encontró que Lynbyabellin I mostró la actividad más potente hacia las células neuro-2a (LC50 0,7mM), mientras que Lyngbyabellin G fue el compuesto menos activo entre todas las Lyngbyabellinas, con valores de CL50 de 2.2 y 4.8μM contra H460 y células neuro-2a, respectivamente.
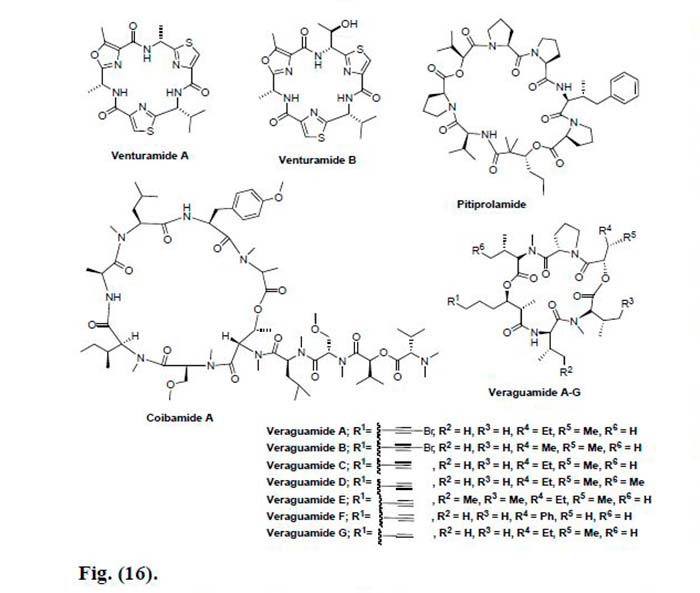
Por otro lado, un depsipéptido cíclico, Coibamida A fue aislado de la cianobacteria marina Leptolyngbya sp. Ésta exhibió una potente citotoxicidad para las células de cáncer de pulmón NCI-H460 y las células de ratón neuro-2a (CL50 <23nM). La Coibamida A se evaluó adicionalmente contra las líneas celulares de cáncer NCI 60 y exhibió una potente actividad y alta selectividad para ciertas líneas celulares de cáncer.

Finalmente, se obtuvieron siete nuevos depsipéptidos cíclicos, Veraguamidas A-G de la cianobacteria Symploca cf. hidnoides recogidos de Cetti Bay, Guam. Estos compuestos se evaluaron para determinar su actividad citotóxica contra el adenocarcinoma colorrectal HT29 y las líneas celulares de carcinoma cervical HeLa. Todos mostraron actividad de moderada a débil, pero las Veraguamidas D y E resultaron ser más activas que los otros derivados con un valor de IC50 de 0.84, 1.5μM contra HT29, respectivamente y 0.54, 0.83μM contra HeLa, respectivamente.

Péptidos marinos de hongos
Los hongos de los océanos son también una fuente rica de metabolitos secundarios de estructura diversa y biológicamente activos. Veamos a continuación algunos de ellos.
Scopularide A y B, son dos péptidos marinos cíclicos que se obtuvieron del hongo marino Scopulariopsis brevicaulis. Ambos compuestos inhibieron significativamente el crecimiento de varias líneas de células cancerosas. Scopularide A inhibió el crecimiento de Colo357, Panc89 (células tumorales pancreáticas) y HT29 (células tumorales de colon) en 36, 42 y 37%, respectivamente, a una concentración de 10μg/mL; mientras que Scopularide B, en la misma concentración, inhibió el crecimiento en 26, 49 y 24%, respectivamente.
El Cordyheptapéptido A se aisló del hongo patógeno de insectos Cordyceps sp. BCC 1788. Isaka et al. también han informado sobre el aislamiento de Cordyheptapéptidos B junto con Cordyheptapéptidos A del mismo hongo Cordyceps sp. pero de diferente cepa. Los Cordyheptapeptidos A y B exhibieron actividad citotóxica potente contra KB (cáncer de epidermoide humano oral), BC (cáncer de mama humano), NCI-H187 (cáncer de pulmón humano de células pequeñas) y Vero (fibroblastos de riñón de mono verde africano) con valores IC50 de 0.78, 0,20, 0,18, 14 \muM y 2,0, 0,66, 3,1, 1,6 \muM, respectivamente.

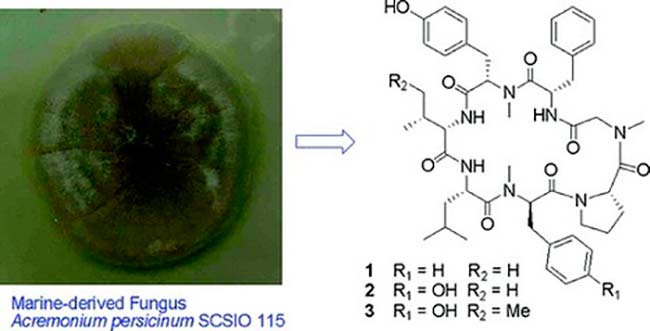
Tres nuevos cicloheptapéptidos, Cordyheptapéptidos C-E, se aislaron del extracto de fermentación del hongo marino Acremonium persicinum SCSIO 115. Estos tres compuestos se evaluaron para determinar sus actividades citotóxicas contra las líneas celulares de glioblastoma humano (SF-268), cáncer de mama humano (MCF-7) y cáncer de pulmón humano (NCI-H460). Se descubrió que el Cordyheptapéptido E es el más potente de los tres, ya que muestra valores de IC50 de 3.2, 2.7 y 4.5μM contra SF-268, MCF-7 y NCI-H460, respectivamente. Además, el Cordyheptapéptido C también mostró una actividad significativa contra las células SF-268 y MCF-7 y NCI-H460 con valores de IC50 de 3.7, 3.0 y 11.6μM, respectivamente; mientras que el Cordyheptapéptido D exhibió actividad leve contra las tres líneas celulares de cáncer.
Un nuevo tetrapéptido cíclico, Asperterrestide A, se aisló del caldo de fermentación del hongo derivado del mar Aspergillus terreus SCSGAF0162. Se probó su citotoxicidad frente al linfoma de monocitos leucémico humano U937, K562 leucémico eritroide, carcinoma gástrico BGC-823, leucemia linfoblástica aguda MOLT-4, adenocarcinoma de mama MCF-7 y líneas celulares de carcinoma de pulmón A549, donde se obtuvieron los valores de IC50 de 1.9, 4.9, 3.5, 1.8, 5.0 y 3.6nM, respectivamente.
Dos nuevos tetrapéptidos cíclicos, Microsporinas A y B, se aislaron a partir de extractos de cultivo del hongo marino Microsporum cf. gypseum obtenido en las Islas Vírgenes de los Estados Unidos. Se evaluó la actividad citotóxica de ambos compuestos contra el adenocarcinoma de colon humano (HCT-116), así como contra 60 líneas celulares de cáncer del Instituto Nacional de Cáncer, donde la Microsporina A mostró citotoxicidad in vitro contra HCT-116 con un valor de CI50 de 0,6μg/ml y un valor medio de CI50 de 2,7μM en las líneas celulares de NCI 60.
La Zygosporamida, un pentadepsipéptido cíclico, se aisló del caldo de fermentación a base de agua de mar del hongo marino Zygosporium masonii. La actividad citotóxica de la Zygoporamida se evaluó también frente a las líneas celulares de cáncer NCI 60, donde mostró una inhibición selectiva de la línea celular de cáncer SF-268 del sistema nervioso central (SNC) y de la línea celular de cáncer renal RXF 393, con valores de GI50 de 6,5nM y menores de 5,0nM, respectivamente.
Finalmente, Sansalvamida A, un depsipéptido cíclico, se obtuvo de un hongo marino del género Fusarium recogido en la isla Little San Salvador, Bahamas. Se descubrió que ésta posee citotoxicidad in vitro frente al carcinoma de colon HCT-116 con un valor de IC50 de 9,8μg/ml, así como también exhibió una mayor potencia hacia la línea celular de cáncer de colon COLO 205 y la línea celular de melanoma SK-MEL-2 con valores de IC50 de 3.5 y 5.9μg/mL, respectivamente.
Péptidos marinos de actinomicetos
Algunos péptidos marinos altamente activos se han aislado de especies de actinomicetos, los cuales son un tipo de bacterias Gram positivas. A continuación se detallan algunos de ellos.
Las Lucentamicinas A-D se aislaron del actinomicetos Nocardiopsis lucentensis recogido en las Bahamas. Las Lucentamicinas A y B mostraron actividad citotóxica in vitro significativa contra la línea celular de carcinoma de colon humano (HCT-116) con valores de IC50 de 0,20 y 11μM, respectivamente. Sin embargo, se descubrió que las Lucentamicinas C y D no son citotóxicas hasta una concentración de 150μM, lo que sugiere que la presencia de un anillo aromático en la estructura es crucial para mostrar la actividad anticancerígena.
Se aisló un nuevo péptido marino cíclico, el Marthiapéptido A, a partir del actinomicetos Marinactinospora thermotolerans SCSIO 00652 de un sedimento profundo del Mar del Sur de China. Marthiapeptide A fue probado contra la línea celular de glioblastoma humano SF-268, la de adenocarcinoma de mama humano MCF-7, la de carcinoma de pulmón humano NCI-H460 y la de cáncer de hepatocarcinoma humano HepG2, usando cisplatino como fármaco de control. Se encontró que Marthiapéptido A era 5-10 veces más potente que el cisplatino y exhibía actividad anticancerígena prometedora con valores de IC50 de 0,38, 0,43, 0,47 y 0,52μM frente a SF-268, MCF-7, NCI-H460 y HepG2, respectivamente.
Se aisló un nuevo depsipéptido bioactivo, la Tiocoralina, del micelio de una cepa de actinomicetos marinos L-1 3-ACM2-092; la cual mostró actividad citotóxica altamente potente contra la leucemia murina P-388, adenocarcinoma de pulmón humano A-549, adenocarcinoma de colon humano HT-29 y líneas celulares de cáncer de melanoma MEL-28 con valores IC50 de 0.002, 0.002, 0.01 y 0.002μg/mL, respectivamente. Además, la Tiocoralina bloquea la proliferación celular en las líneas celulares de cáncer de colon LOVO y SW620, al detener las células en la fase G1 del ciclo celular y al disminuir la velocidad de progresión de la fase S hacia las fases G2 /M.
Negri et al. también evaluaron la actividad citotóxica de la Tiocoralina contra doce líneas celulares de cáncer humano diversas, que incluyen próstata, ovario, mama, melanoma, pulmón- NSCLC, leucemia, páncreas, colon (HT-29, LoVo y LoVo-DOX) y líneas celulares de cérvix (HeLa). La Ticoralina mostró una potencia antitumoral comparable en todas las líneas celulares analizadas en términos de valores de GI50 (concentración de fármaco que causa el 50% de inhibición del crecimiento), con una mediana de 2,4 ± 1,7nM.
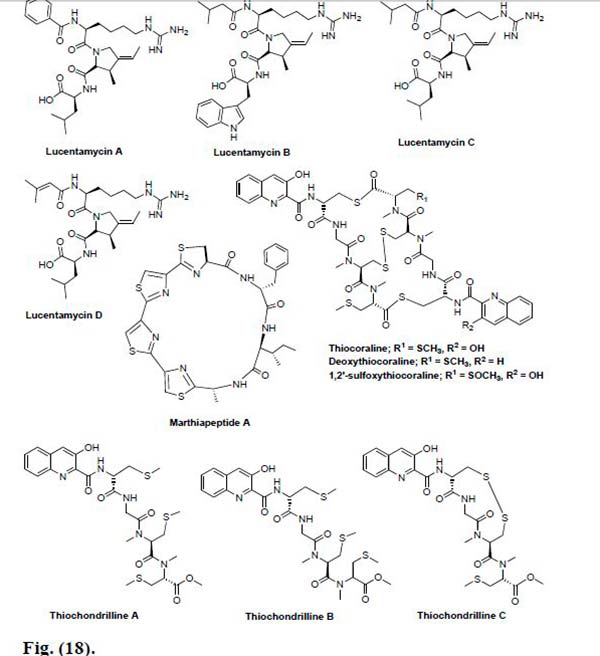
Thomas et al., por su parte, informaron sobre el aislamiento de los primeros análogos de Tiocoralina a partir del género de actinomicetos marino Verrucosispora sp. Los cinco análogos aislados fueron nombrados como 2,2′-Deoxythiocoraline, Thiochondrilline A, Thiochondrilline B, Thiochondrilline C, y 1,2′-sulfoxythiocoraline. Se analizaron los cinco contra la línea celular de cáncer humano A549 y se descubrió que eran menos potentes que la Tiocoralina. Sin embargo, la Desoxitiocoralina, la Tiocondrillina C y la 1,2′-sulfoxitiocoralina, demostraron una citotoxicidad significativa contra dicha línea celular de cáncer, con valores de CE50 de 0.13, 2.86 y 1.26μM, respectivamente.
Péptidos marinos de Streptomyces
Streptomyces es el género más extenso de actinobacterias, un grupo de bacterias Gram Positivas. De este grupo se han extraído varios péptidos marinos.
Sungsanpin, un péptido marino de quince aminoácidos, se obtuvo de una especie de Streptomyces aislada de sedimentos de aguas profundas recogidos en la isla de Jeju, Corea. La actividad de citotoxicidad de Sungsanpin se examinó contra la línea celular de cáncer de pulmón humano A549 en un ensayo de invasión celular, en donde hay que destacar que Sungsanpin no mostró daños celulares graves durante 24 horas a concentraciones de hasta 50μM.
Las Padanamidas A y B se aislaron de cultivos de laboratorio de Streptomyces sp. obtenido de sedimentos marinos recogidos cerca del pasaje Padana Nahua en Papua (Nueva Guinea) . La Padanamida B mostró actividad citotóxica hacia las células de linfocitos T Jurkat (ATCC TIB-152) in vitro con un valor de IC50 de 20μg/mL, mientras que la Padanamida A resultó ser menos potente (IC50 ≈ 60μg/mL) que la Padanamida B.
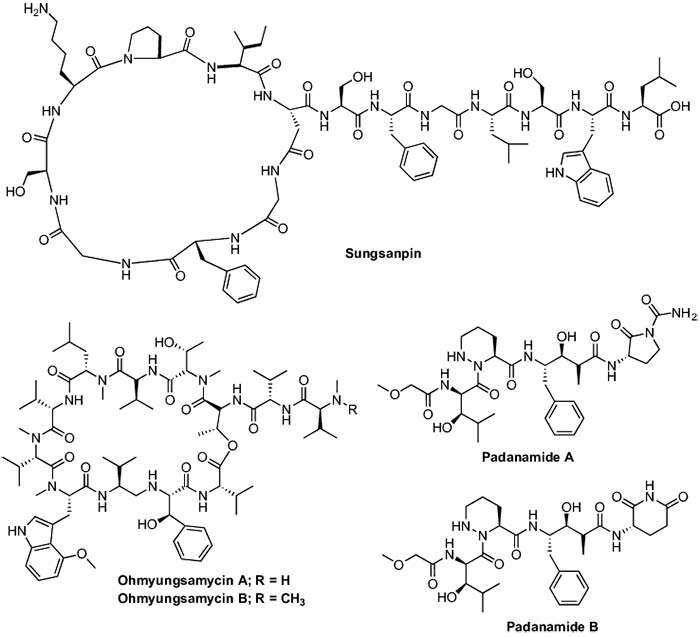
Por último, dos nuevos péptidos marinos cíclicos, Ohmyungsamycins A y B, se aislaron también a partir de una cepa bacteriana marina perteneciente al género Streptomyces recogida en una playa de arena en Jeju, Corea. Ambos compuestos fueron probados por sus actividades inhibidoras contra varias células cancerosas humanas, usando etopósido como fármaco de control. Ohmyungsamycin A exhibió potentes efectos anti proliferativos contra células de cáncer de colon, cáncer de pulmón, cáncer de estómago, cáncer de mama y células de cáncer de hígado, con valores de IC50 de 359, 551, 532, 688, 816nM, respectivamente. Sin embargo, la Ohmyungsamycin B mostró una citotoxicidad débil contra las células cancerosas probadas, con valores de IC50 de 12.4 a 16.8μM. Curiosamente, ambos compuestos no mostraron citotoxicidad (CI50> 40μM) contra células epiteliales de pulmón normales (MRC-5), lo que indica que estos compuestos exhiben actividad anti proliferativa relativamente selectiva contra las células cancerosas en comparación con las células normales.
Conclusión
Tras su trabajo de investigación revisando publicaciones científicas sobre péptidos marinos anti cáncer, los autores concluyen que la investigación sistemática ha conducido al aislamiento e identificación de varios compuestos nuevos biológicamente activos de posible uso terapéutico de fuentes marinas. En este contexto, muchos microorganismos marinos citados, son fuentes prometedoras de nuevos agentes terapéuticos.
Se han desarrollado muchos productos naturales prometedores como agentes anticancerosos y se están realizando esfuerzos adicionales para identificar las posibles moléculas clave. Muchos compuestos aislados de organismos marinos han mostrado una actividad muy potente contra diversas líneas de células cancerosas, por ejemplo, Miliamida B (IC50 = 0,15ng /mL frente a MDA-MB-435), Apratoxina F (IC50 = 2nM frente a H-460), Tiocoralina ( IC50 = 0.002, 0.002, 0.01 y 0.002μg/mL contra P-388, A-549, HT-29 y MEL-28, respectivamente), Apratoxina E (IC50 = 21, 72 y 59nM contra HT29, HeLa, y U2OS , respectivamente).
También se ha visto que análogos sintéticos de algunos compuestos han mostrado actividades anticancerígenas prometedoras. En este sentido, la Elisidepsina (PM02734), un péptido cíclico sintético derivado de la familia Kahalalido F, se encuentra actualmente en ensayos clínicos de fase I / II. Además, D5, un análogo de Dolastatina 10, inhibió la proliferación de células HeLa, MDA-MB-231 y MCF-7 en cultivo con valores de CI50 de 6,8 ± 0,2, 13 ± 5 y 15 ± 7nM, respectivamente.
Cabe destacar que varios péptidos marinos aislados de diferentes organismos marinos también han entrado en ensayos clínicos, algunos de estos son: Dolastatina 10, Didemnina B y Aplidina, donde la Didemnina B fue el primer compuesto marino en ingresar en los primeros ensayos clínicos en humanos en los EE. UU. contra el cáncer. Sin embargo, los ensayos de fase II de Didemninas B no fueron muy satisfactorios. También se están llevando a cabo ensayos clínicos de fase II para la Aplidina en Europa y Canadá.
Tras esto, la investigación interdisciplinaria, los efectos colaborativos, los avances técnicos en el aislamiento y el cultivo de microorganismos, podrían proporcionar la manera de descubrir medicamentos contra el cáncer más prometedores y asequibles en el futuro.
Fuente publicación
Este artículo está publicado originalmente en la revista “Current Protein Science”, bajo la referencia: DOI: 10.2174/1389203717666160724200849; habiendo sido extraído de la web Research Gate donde está con acceso libre. Además, también se puede ver su Abstract en las webs de Bentham Science y NCBI.