
En este artículo se explica que la proteína vitelogenina es sintetizada tanto en el cuerpo graso como en los hemocitos de insectos y que solo la sintetizada en este último, se une a virus de plantas, facilitando así su transmisión.
Presentación del artículo y explicación del ciclo del virus con interacción de la vitelogenina
“Insect tissue-specific vitellogenin facilitates transmission of plant virus” (“La vitelogenina de insectos específica de tejido facilita la transmisión de virus en plantas”), es un artículo publicado en la revista científica “PLOS Pathogens” en febrero de 2018 por los autores: Yan Huo, Yuanling Yu, Liying Chen, Qiong Li, Mengting Zhang, Zhiyu Song, Xiaoying Chen, Rongxiang Fang y Lili Zhang; el que explican que la vitelogenina también es sintetizada en los hemocitos de la hemolinfa de insectos (de Laodelphax striatellus (Fallén, 1826) en este caso), además de en el cuerpo graso, y que en la hemolinfa, se une al virus de plantas (al Rice Stripe Virus (RSV) en este caso), facilitando así su transmisión entre los propios insectos y hacia las plantas.
La vitelogenina o vitellogenin (Vg) es una proteína precursora de las proteínas de almacenamiento del huevo, indispensable en casi todos los animales ovíparos. En los insectos, la vitelogenina se suele sintetizar en el cuerpo graso, y después es modificada y secretada a la hemolinfa, donde será captada por los ovocitos mediante endocitosis. Cabe indicar que dicha proteína sufre modificaciones co y post-traduccionales, así como escisión proteolítica, tras la cual, el precursor primario de vitelogenina, se separa en dos subunidades, una grande y otra pequeña, las cuales se ensamblan en tejidos antes de ser secretadas a la hemolinfa. Sin embargo, solo la subunidad pequeña es la que se secreta en la hemolinfa, mientras que la grande se consume en el cuerpo graso. De este modo, parte de la vitelogenina es sintetizada en los hemocitos que componen la hemolinfa, la cual es la que se va a unir al virus.
Asimismo, se ha visto que los machos y las ninfas de Laodelphax striatellus (Fallén, 1826) también sintetizan vitelogenina (pero solo en los hemocitos), además de las hembras, lo que indica que la función de ésta se extiende más allá de servir como una reserva de energía para la nutrición de embriones en desarrollo. De hecho, se ha informado que la vitelogenina puede matar bacterias, a través de la interacción con lipopolisacáridos y ácido lipoteicoico presentes en las paredes celulares de esas bacterias, así como neutralizar virus al unirse y crear enlaces cruzados entre los viriones, y posee propiedades inmunológicas en las abejas, transportando moléculas derivadas de microbios a los huevos en desarrollo.
Por otro lado, el virus de la franja o de arroz (Rice stripe virus (RSV)), es el causante de la enfermedad de la raya del arroz, la cual está siendo un grave problema para la producción de arroz, provocando epidemias repetidamente en China, Japón y Corea. La transmisión de este virus, depende completamente de los vectores de insectos, siendo el más importante el Laodelphax striatellus (Fallén, 1826), en el cual también puede transmitirse verticalmente, pasando del insecto madre a sus descendientes, gracias a la interacción de éste con la vitelogenina, de modo que se protege al virus para su supervivencia en la hemolinfa y mejora de los dos tipos posteriores de transporte viral.

Así pues, en el ciclo vital de este virus, éste es transmitido por L. striatellus de manera persistente y propagativa. Las partículas de ribonucleoproteínas filamentosas del virus, son ingeridas por individuos de L. striatellus que se alimentan de plantas infectadas por el RSV. Una vez dentro del insecto, el virus invade el epitelio del intestino medio para establecer la infección, luego se disemina dentro del intestino y posteriormente en la hemolinfa. Desde la hemolinfa, el virus infecta además varios tejidos de L. striatellus, incluidas las glándulas salivales. El RSV se transmite entonces horizontalmente, desde las glándulas salivales a una planta saludable. Sin embargo, también invade los ovarios femeninos, desde donde se transmite verticalmente a la descendencia. Esta transmisión vertical da lugar a L. striatellus infectado con RSV, lo que presenta un desafío adicional en el control de la enfermedad.
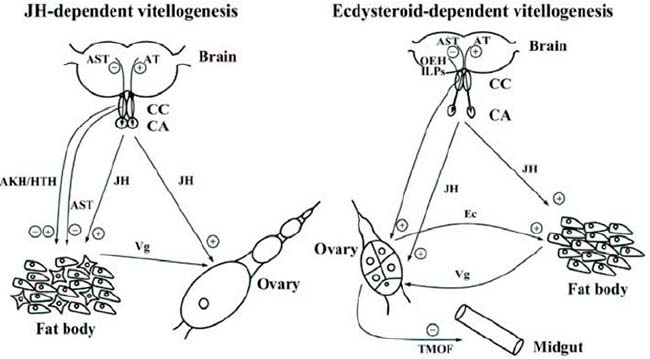
Con todo esto, en el artículo aquí presentado, sus autores revelan, por primera vez, que la vitelogenina de insectos transportada al ovario, también es producida por tejidos distintos al cuerpo graso. Además, han identificado la forma molecular específica de tejido de vitelogenina, responsable de su función biológica en la transmisión vertical del virus; así como también han descubierto la expresión no femenina de esta proteína y determinaron su función en la transmisión horizontal del virus. Todos estos hallazgos, proporcionan nuevos conocimientos sobre la transmisión de virus de plantas dentro del vector, una parte importante y menos explorada del ciclo de vida del virus, pero necesaria para el diseño de nuevas estrategias de control de enfermedades.
Métodos
A continuación os indicamos cuáles fueron los métodos que siguieron los investigadores para obtener y procesar las muestras que necesitaron, y así obtener esas conclusiones.
Obtención de virus, SBPHs y plantas hospedadoras
Los individuos de L. striatellus libres e infectados por RSV utilizados en este estudio, fueron capturados originalmente en la provincia de Jiangsu (China), y se mantuvieron en el laboratorio. Para asegurar una alta tasa de infección de la descendencia, se cultivaron por separado las hembras virulíferas, y se probaron el 15% de sus descendientes, para detectar la infección por RSV a través de un ensayo inmunoabsorbente ligado a enzimas puntuales, utilizando anticuerpos monoclonales específicos de VRS. Estos anticuerpos se usaron en todos los experimentos in vivo que se realizaron para determinar la localización del virus o la co-localización con la subunidad de la vitelogenina (LsVg). Así pues, finalmente, se utilizó una población de insectos con una tasa de infección prevista del 100%.
Por otro lado, todas las plantas utilizadas para la crianza de L. striatellus, se cultivaron dentro de una incubadora de crecimiento a 25°C, bajo un fotoperíodo de 16 h de luz/8 h de oscuridad.

Recolección de tejidos de L. striatellus (SBPH)
Para el aislamiento de la hemolinfa, los insectos se anestesiaron a -20 grados centígrados durante 3 minutos. Sólo se recogieron gotas claras de hemolinfa para evitar la contaminación por grasa corporal. Los insectos SBPH se diseccionaron en tampón PBS previamente enfriado. Se recolectó la mayoría del cuerpo graso sin contaminación de otros tejidos y fue colocado en un tampón PBS; mientras que los tejidos que incluían el intestino medio, las glándulas salivales, los ovarios de la hembra y los testículos del varón, se lavaron dos veces en PBS para eliminar los virus o proteínas contaminantes de la hemolinfa.
Procesamiento de material genético mediante PCR
Después de la recolección de tejidos, se extrajo ARN de éstos y se llevó a cabo una PCR de transcripción inversa y una qPCR, basada en SYBR-Green; así como las copias de ARN viral fueron medidas mediante una qRT-PCR.
Preparación de anticuerpos
Los anticuerpos monoclonales anti-vitelogenina de ratón, fueron preparados por Abmart (Shanghai, China) y fueron designados como Ab47Km y Ab111Km en este estudio. Para preparar los anticuerpos específicos de la subunidad de vitelina (LsVn), los péptidos KSRRNILPQSDSNQ, AQVDSDTKHMR, YKNPGEAPELR y RMQPLNKEEKQNVF, fueron conjugados e inyectados en conejos, y los antisueros correspondientes, fueron preparados por GenScript (Nanjing, China). Los anticuerpos producidos se designaron como Ab42K, Ab67K1, Ab67K2 y Ab111K, respectivamente.
Preparación de muestras para microscopio
Los tejidos de los insectos se colocaron en PBS en portaobjetos de vidrio y se dejaron secar. Los tejidos se fijaron luego en paraformaldehído al 4% a temperatura ambiente durante 30 min. Los portaobjetos se enjuagaron dos veces con PBS y luego se incubaron en PBST/FBS durante 30 min. Para detectar la localización de la subunidad de vitelogenina (LsVg) en los diferentes tejidos, los portaobjetos se incubaron con anticuerpo monoclonal anti-Vg de ratón Ab47Km (dilución 1:300 en PBST/FBS) durante 1 hora, y luego con anticuerpo anti-ratón de cabra marcado con Alexa 568 (dilución 1:200 en PBST/FBS) durante 1h. Los portaobjetos se enjuagaron tres veces con PBST y los nucléolos se tiñeron con yoduro de TO-PRO-3 a temperatura ambiente durante 3 minutos. Finalmente, las muestras se examinaron utilizando un microscopio confocal Leica TCS SP8.
Para detectar la co-localización de LsVg con el virus RSV en los tejidos SBPH, el anticuerpo monoclonal anti-RSV se marcó con Alexa Fluor 488. Los portaobjetos se incubaron secuencialmente durante 1h cada uno con el anticuerpo Ab47Km (1:300 diluido en PBST/FBS), anticuerpo anti-ratón de cabra marcado con Alexa 568 (1:200 diluido en PBST/FBS) y con anticuerpo monoclonal anti-RSV marcado con Alexa 488, y luego teñido con yoduro de TO-PRO-3 durante 3 min.
Para detectar la co-localización de subunidades de vitelina (LsVn) con RSV, los portaobjetos se incubaron con anticuerpos anti-RSV de ratón y anti-LsVn de conejo (Ab42K, Ab67K2 o Ab111K; dilución 1:1000 en PBST/FBS), seguido de anticuerpos anti-ratón de cabra marcada con Alexa 488 y anti-conejo de cabra marcados con Alexa 568 (dilución 1:200 en PBST/FBS), y finalmente con yoduro TO-PRO-3 para la tinción de nucléolo.
Para detectar la co-localización de subunidades LsVg en hemocitos, se utilizaron Ab42K y Ab111Km como anticuerpos primarios, y se usaron anticuerpos anti-conejo de cabra marcados con Alexa 568 y anticuerpos anti-ratón de cabra marcados con Alexa 488, como anticuerpos secundarios.
Por último, para detectar la co-localización de LsVg con E. coli en hemocitos, las bacterias que expresan GFP se suspendieron en agua estéril. Posteriormente, se administraron 13,8nl de la suspensión bacteriana en el hemocel de ninfas de tercer estadio. 1,5h después de la microinyección, se diseccionaron los insectos y se recogió la hemolinfa. Se prepararon portaobjetos para microscopía confocal. En este caso, el anticuerpo primario para la detección de LsVg fue Ab42K y la tinción se realizó con Alexa 568.

Purificación de vitelinas e identificación de péptidos de vitelogenina por espectroscopia de masas
Para la purificación de las vitelinas, las hembras de L. striatellus recién nacidas, se dejaron crecer durante 3 días antes de la extracción. Dos gramos de los insectos se molieron en nitrógeno líquido y se incubaron en 1ml de solución de NaCl 0,4M durante 20 minutos a 4°C. La suspensión se centrifugó a 3.300× g durante 10 minutos a 4°C para eliminar los residuos de insectos. El sobrenadante también se centrifugó tres veces a 1.000× g durante 10 minutos a 4°C para eliminar el lípido en su superficie.
Después, a la muestra se le añadieron 8ml de ddH2O y se incubó durante la noche a 4°C, seguido de una centrifugación (1,000x g, 20min, 4°C) para precipitar la vitelina. La proteína precipitada, se disolvió en 1ml de solución de NaCl 0,4M y se centrifugó de nuevo (3,300× g, 10min, 4°C) para eliminar cualquier precipitado no disuelto. El sobrenadante final se aplicó a una columna Superdex 200 10/300GL de exclusión por tamaño y se recogieron las fracciones que contenían vitelina de la concentración y pureza más altas.
Para el análisis de espectroscopia de masas, la proteína purificada se separó en un gel de SDS-PAGE al 10% y se tiñó con azul de Coomassie (Bio-Rad). Las bandas correspondientes a las subunidades de vitelina de 178, 111, 67 y 42 kDa, se cortaron y digirieron, y los péptidos se sometieron a cromatografía líquida y análisis de espectrometría de masas en tándem. Los péptidos se identificaron utilizando un LTQ-Orbitrap XL con Easy nLC-1000 (Thermo Fisher Scientific), y los datos de proteómica se analizaron utilizando Proteome Discoverer 1.4 (Thermo Fisher Scientific).

Análisis de Western Blot
Para confirmar la composición de la subunidad LsVn, la proteína vitelina purificada se fraccionó en un gel de SDS-PAGE al 10% (Bio-Rad) y se procesó para inmunotransferencia. Los anticuerpos específicos de la subunidad LsVn/LsVg, Ab42K, Ab67K1, Ab67K2 o Ab111K, se usaron para probar las subunidades LsVn correspondientes. Los anticuerpos unidos se detectaron utilizando anticuerpos secundarios de cabra anti-conejo conjugados con peroxidasa de rábano picante (Sigma), y las transferencias se desarrollaron utilizando el Sistema de Detección de Transferencia de Western por quimioluminiscencia mejorada (GE Healthcare).
Se realizó Western blot para medir la composición de la subunidad y los tamaños moleculares de LsVg en el cuerpo graso y en los hemocitos. Para ello, los tejidos de 50 insectos hembra, se colocaron en 100µl de tampón PBS y se hirvieron en tampón de carga SDS-PAGE.
Cuando las mismas cantidades de proteínas totales se cargaron en el gel, encontraron que la vitelogenina se escindió en dos subunidades, una subunidad pequeña de 60 kDa y una grande de 200 kDa; sin embargo, la concentración de las dos subunidades en los diferentes tejidos fue muy diferente.
Dado que era difícil determinar si la subunidad grande existía en el cuerpo graso o si la subunidad pequeña se secretaba del cuerpo graso, ajustaron la carga de transferencia Western con la misma cantidad de la subunidad pequeña LsVg como control, y compararon las cantidades de la subunidad grande para determinar la distribución de ésta.
A continuación, realizaron la transferencia Western con Ab47Km para determinar las cantidades de la subunidad pequeña en el cuerpo graso y el hemolimo. Luego, se aplicaron muestras de grasa corporal y de hemolinfa con la misma cantidad de la subunidad pequeña a la SDS-PAGE, y se sondaron con los anticuerpos Ab42K, Ab67K2 o Ab111K.
ARN de interferencia (RNA interference)
Dos fragmentos de ADN, uno específico de las secuencias codificantes de la subunidad pequeña N-terminal y el otro de la subunidad grande C-terminal, se amplificaron por PCR y se designaron como VgN y VgC, respectivamente. Se sintetizó DsRNA y se administró 36.8nl de dsRNA a 1ng/nl en el hemocel de insecto para el silenciamiento de genes.
Para confirmar que ambas subunidades de vitelogenina se expresaron a partir de la misma transcripción, se administró dsRNA de VgC en el hemocel de los individuos del quinto estadio ninfal. Los insectos se cultivaron en nuevas cámaras con plántulas de arroz saludables hasta la aparición de adultos. Las hembras fueron trasladadas a nuevas cámaras por 48h adicionales de cultivo. Luego, se diseccionaron los insectos y se prepararon los extractos de proteínas del cuerpo graso para el análisis de expresión de vitelogenina. La transferencia Western se realizó de acuerdo con el procedimiento descrito anteriormente. Los anticuerpos utilizados para la detección de la subunidad de vitelogenina que expresa el cuerpo graso, fueron Ab42K y Ab67K2.
Para determinar la influencia de LsVg en la transmisión horizontal del virus RSV, se administró dsRNA de VgC en el hemocel de ninfas de tercer estadio infectadas por RSV de L. striatellus. En el día 6 de cultivo en nuevas cámaras, se recogió un subconjunto de los insectos y se midió la expresión de vitelogenina en sus hemocitos mediante microscopía confocal. Se recogieron los insectos restantes y se midieron los títulos del virus RSV en diversos tejidos, los cuales fueron determinados mediante qRT-PCR.
Para determinar el efecto de LsVg en la supervivencia del virus RSV dentro de la hemolinfa, se administró ARNbc de VgC en el hemocel de individuos de L. stiatellus de ninfa de tercer estadio libres de RSV. Después de 72h de cultivo en nuevas cámaras, se recogieron algunos de los insectos y se midió la expresión de vitelogenina en sus hemocitos mediante microscopía confocal. Después, se microinyectaron RNPs de virus purificados en tampón PBS en el hemocoel de insecto. A las 1, 6, 12 y 24h después, se extrajo el ARN de todo el cuerpo del insecto y se midieron los títulos de virus.
Análisis estadístico
Todos los gráficos y análisis estadísticos se realizaron utilizando el software Prism 6.0. Los datos se expresaron como medias ± desviación estándar (DE). La importancia de las diferencias entre los grupos se evaluó mediante la prueba t de Student.
Resultados del estudio
A continuación, os vamos contando cada uno de los hallazgos de este estudio.
Múltiples tejidos de L. striatellus hembra expresaron vitelogenina
En otro estudio anterior, se viera que el virus entrara en el ovocito de L. striatellus al unirse a la proteína vitelogenina antes de llegar al germario. Para determinar en qué tejido/s se produce la interacción RSV-LsVg, en este trabajo se analizaron los niveles de expresión de LsVg en varios tejidos femeninos de L. striatellus y se llevaron a cabo distintos experimentos para localizar la proteína vitelogenina. Los tejidos analizados incluyeron: el cuerpo graso, los hemocitos, el intestino medio y las glándulas salivales, todos ellos propuestos previamente como participantes en la transmisión de virus propagativos persistentes.
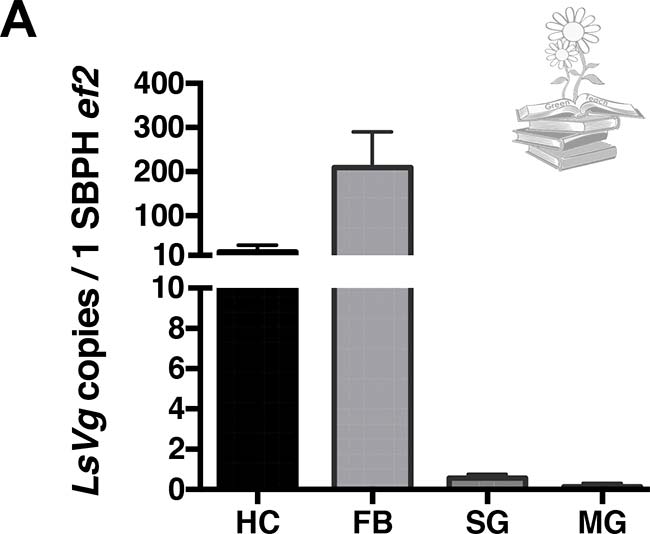
Para ello, se realizó una PCR cuantitativa en tiempo real (qRT-PCR) para probar los niveles de expresión del gen LsVg. Tanto el cuerpo graso como los hemocitos, produjeron abundante ARNm de vitelogenina. Por el contrario, solo algunas de las muestras de glándulas salivales y del intestino medio, mostraron una expresión de vitelogenina, todas a niveles bajos, tal y como se puede observar en la siguiente Figura.
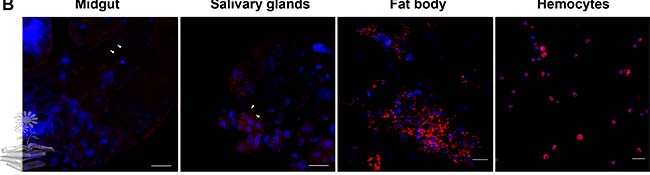
Por otro lado, se realizó un ensayo de inmunofluorescencia (IFA) para visualizar la distribución de la proteína vitelogenina. Usando un anticuerpo monoclonal específico de LsVg (Ab47Km), se encontró que la proteína LsVg se localiza en cuatro tipos de tejido en abundantes abundancias, tal y como se indica en las distintas imágenes de la siguiente Figura.
De acuerdo con los niveles de ARNm observados, la vitelogenina se sintetizó abundantemente, tanto en el cuerpo graso como en los hemocitos, pero solo en los niveles detectables en algunas de las muestras de glándulas salivales e intestino medio.
Dado que múltiples tejidos de L. striatellus expresaron la vitelogenina y que tanto el cuerpo graso como los hemocitos produjeron la proteína a niveles altos, a continuación, se investiga si el LsVg de estos tejidos juega un papel en la mediación de la transmisión del virus RSV.
Solo la vitelogenina producida en hemocitos está co-localizada con el virus RSV in vivo
Para determinar el tejido o el espacio en el que se produjo la interacción LsVg-RSV, se realizaron IFAs para detectar dicha co-localización, donde se vio que el virus se distribuyó en los cuatro tejidos de L. striatellus analizados, pero LsVg y RSV se co-localizaron solo en hemocitos, tal y como se puede observar en las siguientes imágenes. A pesar de que la vitelogenina era abundante en el cuerpo graso, la proteína no se co-localizó con el RSV en ese tejido, así como tampoco se observó una co-localización entre el RSV y los niveles bajos de LsVg en el intestino medio o las glándulas salivales.
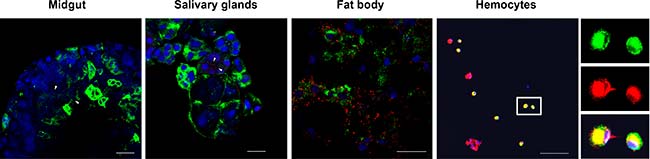
Visto esto, se plantea la hipótesis de que la vitelogenina de este insecto se procesa específicamente para el tejido y que la forma molecular existente en el cuerpo graso es incapaz de interactuar con el RSV. Para probar esta hipótesis, se analizó el perfil de escisión de LsVg, utilizando anticuerpos anti-LsVg específicos de subunidad de vitelogenina, para investigar la composición de dicha subunidad en diferentes tejidos.
La vitelogenina se escindió proteolíticamente dando lugar a 4 subunidades detectables
Generalmente, la vitelogenina de insectos se escinde proteolíticamente antes de su secreción en la hemolinfa, y las subunidades de vitelogenina, se procesan, en algunos casos, aún más en los ovarios. Para revelar los patrones de procesamiento de esta proteína en diferentes tejidos, primero se analizó la composición de la subunidad de la vitelina, y luego se utilizaron anticuerpos específicos de la subunidad para determinar la forma molecular de LsVg en tejidos particulares.
Tal y como se contó, la vitelina se purificó a partir de insectos hembras 3 días después de la muda, y las subunidades de ésta, se fraccionaron mediante SDS-PAGE. El LsVn purificado se resolvió en cuatro bandas principales bien separadas con tamaños moleculares de aproximadamente: 178, 111, 67 y 42 kDa.
La espectrometría de masas se realizó para identificar los péptidos derivados de LsVg de las cuatro bandas de SDS-PAGE. La localización de los golpes de péptidos identificados, reveló que las bandas de 42 y 178 kDa correspondían a las partes N y C de la proteína vitelogenina, respectivamente. Los impactos de péptidos de las bandas de 67 y 111 kDa se incluyeron en la subunidad grande de 178kDa, donde se agruparon en sus partes N y C, respectivamente.
Estos resultados revelaron el perfil de escisión de la vitelogenina. En particular, la proteína precursora se divide primero en subunidades pequeñas (42 kDa) y grandes (178 kDa), y esta última se divide adicionalmente en dos subunidades de tamaño mediano (67 y 111 kDa). Como las vitelogeninas de insecto generalmente se escinden en el motivo de tetra-residuo RXXR por endoproteasas, la composición de la subunidad LsVn sugirió la existencia de dos posibles sitios de escisión RXXR.

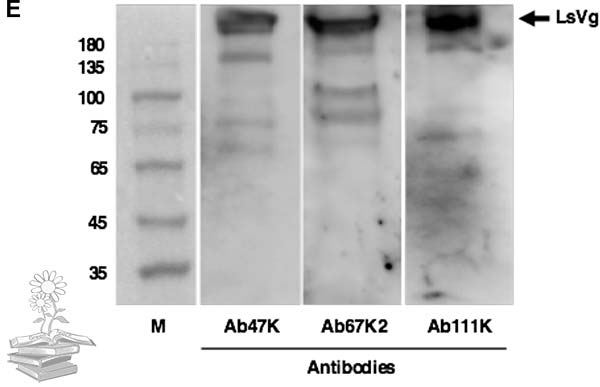
Se produjeron anticuerpos basados en péptidos para el reconocimiento específico de las correspondientes subunidades LsVn. Así, los anticuerpos Ab42K y Ab111K se produjeron en base a péptidos dentro de las regiones confirmadas por espectrometría de masas de las subunidades LsVn de 42 y 111 kDa. Debido a que se distribuyeron múltiples motivos RXXR dentro de la subunidad LsVn de 67 kDa calculada, se produjeron dos anticuerpos, Ab67K1 y Ab67K2, para reconocer diferentes regiones de este fragmento.
La transferencia de Western confirmó los motivos de escisión RXXR predichos. Como era de esperar, el anticuerpo Ab42K reconoció la banda de 42 kDa, tanto Ab67K1 como Ab67K2 reconocieron la banda de 67 kDa, así como la banda de 178 kDa, y Ab111K exhibió señales inmunorreactivas a las bandas de 111 y 178 kDa. Además, la pequeña subunidad LsVn tenía un peso molecular (42kDa) más bajo que el valor calculado de 47kDa, lo que sugiere que podría ocurrir un procesamiento adicional en los ovarios, pero el cual no está claro.
De acuerdo con el patrón de escisión de vitelogenina observado, se usaron tres anticuerpos específicos de subunidad (Ab42K, Ab67K2 y Ab111K) en los experimentos posteriores, para analizar las formas moleculares de vitelogenina presentes en diferentes tejidos.
El cuerpo graso albergaba principalmente la subunidad pequeña de vitelogenina
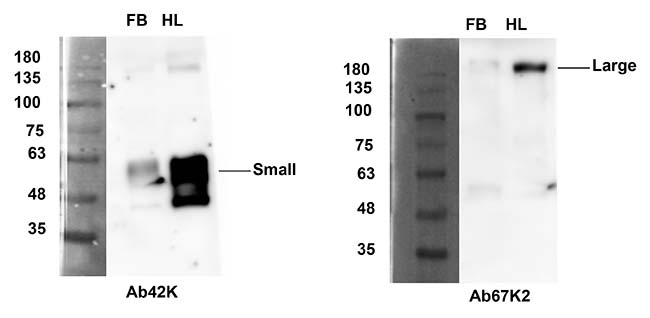
Se realizó un IFA utilizando anticuerpos específicos de subunidades para detectar su distribución. El uso del anticuerpo Ab42K, dio como resultado señales inmunorreactivas, tanto en el cuerpo graso como en los hemocitos. Por el contrario, Ab67K2 y Ab111K produjeron señales inmunorreactivas solo en hemocitos, tal y como se puede observar en las siguientes imágenes. Estos resultados indican que solo el extremo N-terminal de la vitelogenina existe en el cuerpo graso.
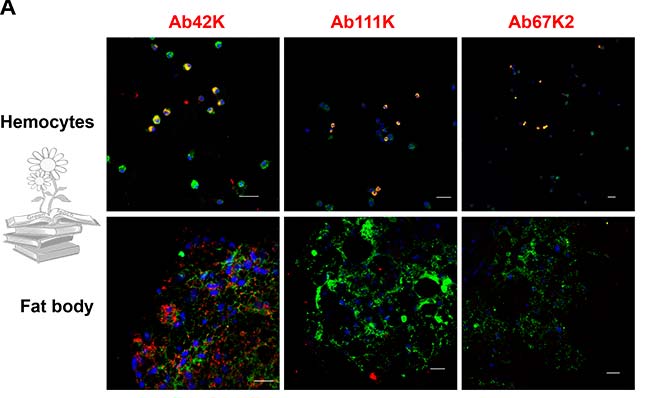
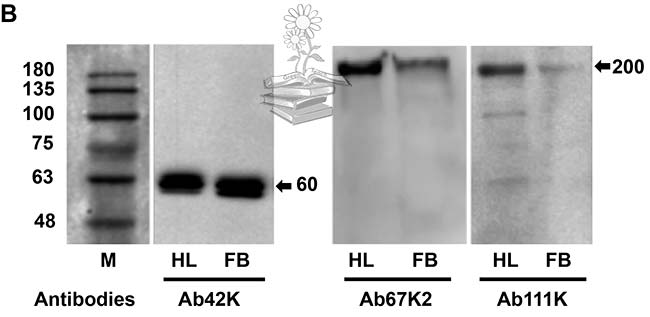
Tras realizar una transferencia Western para determinar los pesos moleculares y la composición de las subunidades de las proteínas en el extracto de grasa corporal y la hemolinfa, usando el anticuerpo Ab42K, se detectó una banda de 60kDa para ambos casos. Los anticuerpos Ab67K2 y Ab111K reconocieron una banda fuerte de aproximadamente 200kDa en la hemolinfa, así como una banda similar pero mucho más débil en el extracto de grasa corporal, tal y como puede verse en la figura de abajo.
Como ninguno de los tres anticuerpos reconoció la proteína vitelogenina de longitud completa, se plantea la hipótesis de que la proteína, cuando se sintetiza, experimenta una rápida escisión para producir dos subunidades con tamaños moleculares de 60 y 200kDa, y mientras que ambas subunidades existen dentro de los hemocitos, solo la subunidad pequeña de 60kDa existe en el cuerpo graso. Estos resultados también sugirieron que LsVg se escindió en un solo sitio (RSRR) antes de la invasión de las proteínas a los ovarios.
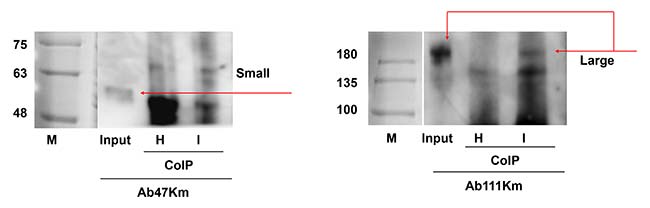
Asimismo, también se llevó a cabo un ensayo de coinmunoprecipitación para confirmar la interacción física in vivo entre el virus RSV y las subunidades de vitelogenina. Los anticuerpos anti-RSV coinmunoprecipitaron la subunidad grande pero no la pequeña, de los extractos brutos femeninos, lo que confirma que la interacción física ocurrió entre el RSV y la subunidad grande de LsVg.
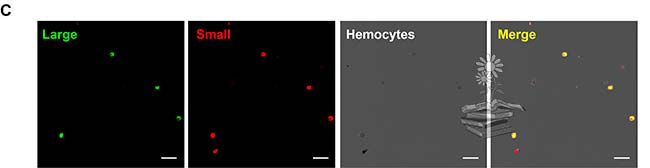
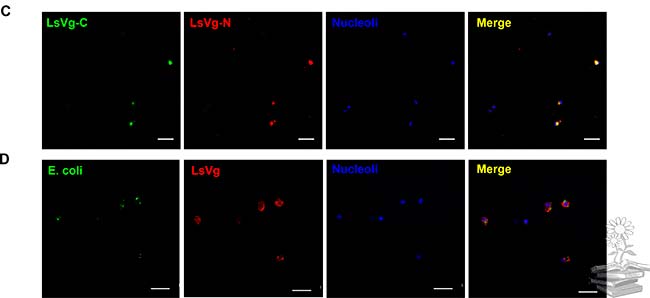
Por otro lado, se realizó un ensayo de inmunofluorescencia dual para analizar el patrón de distribución de las dos subunidades de vitelogenina dentro de los hemocitos. Para ello, se probaron dos anticuerpos diferentes: el Ab111Km seguido de la tinción con el colorante fluorescente Alexa 488, y el anticuerpo Ab42K que se tiñó con Alexa 568. Los dos tipos de señales de fluorescencia se fusionaron en todos los hemocitos con vitelogenina, lo que indica la coexistencia de subunidades LsVg N y C-terminales dentro de los hemocitos, lo cual puede observarse en la siguiente imagen. Estos resultados, combinados con los tamaños de proteína revelados por Western blotting, indicaron que la vitelogenina existe en los hemocitos como un complejo de subunidades grandes y pequeñas.
Por otra parte, también se usó la interferencia de ARN (ARNi) con el ARN de doble cadena de la subunidad grande de vitelogenina, para la expresión del gen de desactivación, y luego, se midió el nivel de expresión de la subunidad pequeña. La transferencia de Western con los anticuerpos Ab42K y Ab67K2, reveló una disminución espectacular de los niveles de proteína LsVg después de la destrucción de genes, lo que indica que una sola transcripción ya contiene las subunidades grandes y pequeñas.
Tomados en conjunto, estos resultados indicaron que la proteína LsVg se expresa tanto en los hemocitos como en el cuerpo graso de L. striatellus. Después de la síntesis, la proteína se escinde en el motivo RSRR, dando como resultado subunidades grandes y pequeñas. El complejo de dos subunidades existe en los hemocitos, mientras que solo la subunidad pequeña permanece en el cuerpo graso, donde se va consumiendo por un proceso que todavía no está claro.
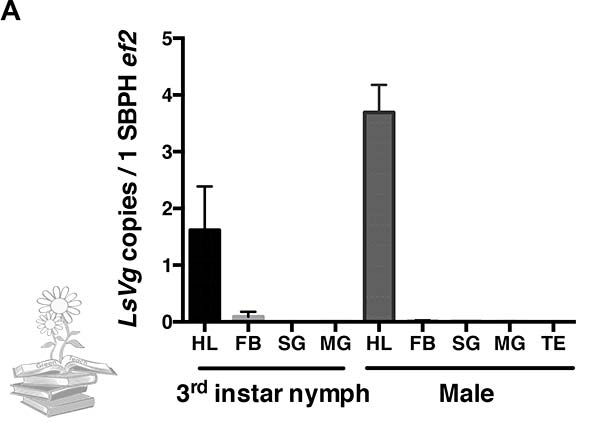
La vitelogenina también fue expresada por ninfas y machos en los hemocitos y junto al virus de la raya del arroz
Además de nutrir embriones en desarrollo, los hemocitos de insectos y la hemolinfa, juegan un papel clave en la inmunidad innata. Por lo tanto, se investigó si la vitelogenina también se expresa por hemocitos de ninfa o machos de L. striatellus. De acuerdo con un análisis de qRT-PCR, tanto las ninfas como los machos expresaron LsVg, y los hemocitos fueron el único tejido en el que se expresó.
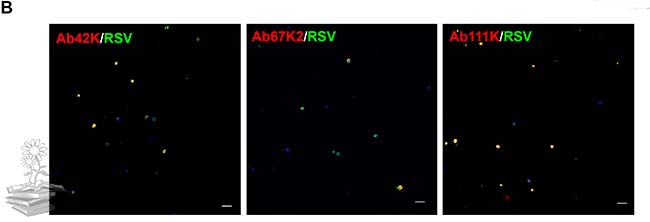
Un IFA que utiliza los tres anticuerpos específicos de subunidad (Ab42K, Ab67K2 y Ab111K) confirmó aún más los resultados de qRT-PCR. En este caso, todos los anticuerpos reaccionaron a las subunidades correspondientes en los hemocitos.
También se utilizó un experimento de inmunofluorescencia dual con Ab42K y Ab111Km para revelar la co-localización de las subunidades grandes y pequeñas. Para excluir la posibilidad de que la vitelogenina se uniera a varios patógenos de manera no específica, microinyectaron Escherichia coli en la hemolinfa de L. striatellus y buscaron la localización de la proteína LsVg con las bacterias fagocitadas. Las bacterias no se co-localizaron con LsVg dentro de los hemocitos, lo que indica que la interacción entre RSV y LsVg es un evento específico.
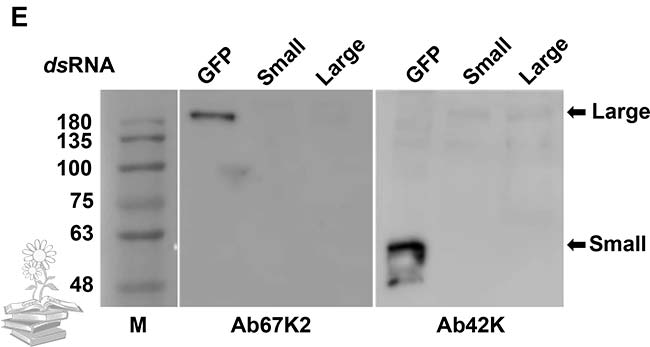
Asimismo, también se realizó Western blot para determinar la composición de la subunidad de LsVg en los hemocitos masculinos. Los tres anticuerpos Ab47K, Ab67K2 y Ab111K, reconocieron una banda fuerte de más de 200kDa en la hemolinfa, lo que indica que la vitelogenina en el macho, permaneció en su forma molecular de longitud completa.
La deficiencia de vitelogenina disminuyó también la cantidad de virus RSV en la hemolinfa
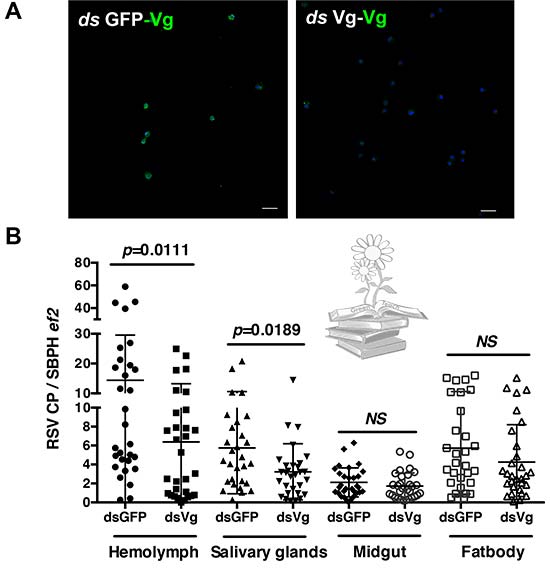
Para determinar el papel de la vitelogenina en la mediación de la supervivencia y transmisión del virus RSV dentro de los insectos, se generaron ninfas de L. striatellus deficientes en LsVg. En el día 6 después del inicio de la alimentación, los niveles de expresión de LsVg en los hemocitos analizados por IFA usando el anticuerpo Ab111Km, mostraron una reducción dramática.
Luego, se evaluó si la transmisión de RSV estaba afectada por la deficiencia de LsVg mediada por RNAi. En comparación con el grupo de control, los L. striatellus tratados con LsVg dsRNA, mostraron títulos de RSV similares en el intestino medio y en el cuerpo graso, mientras que se observaron títulos de virus significativamente más bajos en la hemolinfa y las glándulas salivales. Estos resultados indican que la vitelogenina funciona para facilitar la supervivencia y la transmisión del virus RSV a través del entorno de hemolinfa hostil.
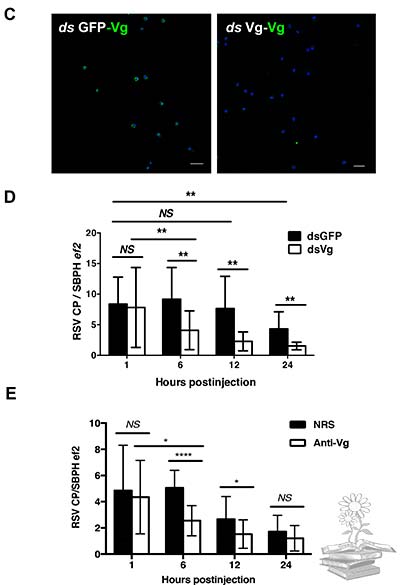
Para confirmar la función de la vitelogenina, se administraron volúmenes iguales de LsVg o GFP dsRNA en el hemocel de ninfas de L. striatellus sin RSV, mediante microinyección. A las 72h, cuando los niveles de expresión de LsVg se redujeron drásticamente mediante el tratamiento con dsLsVg, se administró directamente RSV purificado en el hemocel de insecto. A las 1, 6, 12 y 24h posteriores, los títulos de RSV en el cuerpo de L. striatellus se evaluaron mediante qRT-PCR. En comparación con el grupo de control tratado con GFP dsRNA, los L. striatellus tratados con LsVg dsRNA, mostraron títulos de virus significativamente más bajos a partir de las 6h posteriores a la inyección. Estos resultados confirmaron que la vitelogenina producida por los hemocitos, desempeña un papel en la facilitación de la supervivencia del VRS en el entorno de hemolinfa hostil.
Por su parte, el experimento de inmunobloqueo con anticuerpos anti-Vg, reveló resultados similares. La inoculación del anticuerpo anti-Vg en el hemolimo antes de la administración del RSV, disminuyó la supervivencia del RSV en la hemolinfa, especialmente en las etapas iniciales (6h y 12h); sin embargo, la diferencia no fue significativa en la etapa posterior (24h). Esto puede deberse a que la mayoría de los RSV estuvieran dentro de los hemocitos en la etapa tardía, por lo que el inmunobloqueo no afectó la función de la vitelogenina intracelular.
Discusión
Se ha informado que los virus de plantas alcanzan la transmisión vertical dentro de vectores de insectos a través del sistema de transporte transovarial de la proteína Vitelogenina del insecto. Tradicionalmente, se ha pensado que la vitelogenina transportada a los ovarios se sintetizaba en el cuerpo graso. Sin embargo, en este estudio, han demostrado que los hemocitos de L. striatellus también sintetizan abundantes proteínas vitelogeninas y que solo la producida por los hemocitos interactúa con el virus RSV in vivo.
Al aclarar la composición de la subunidad de vitelina y al usar anticuerpos específicos para ella, se reveló que la vitelogenina se sintetiza y se escinde proteolíticamente en la subunidad pequeña N-terminal y en la subunidad grande C-terminal, tanto en el cuerpo graso como en los hemocitos. La gran subunidad producida en el cuerpo graso se consume aún más, mientras que la gran subunidad que permanece en los hemocitos es capaz de interactuar con el virus RSV. Además, se demuestra que la vitelogenina también se expresa en insectos masculinos y ninfales, teniendo una función independiente de género, ya que el LsVg expresado en los hemocitos no femeninos, también puede interactuar con el RSV in vivo, protegiendo así al virus del ambiente de hemolinfa hostil y facilitando su infección sistémica.
Con esto, este estudio identificó a los hemocitos, un componente importante del sistema inmunológico de los insectos, como un nuevo tejido productor de vitelogenina, tratándose éste del primer estudio que demuestra que los hemocitos expresan un gen de vitelogenina de insecto.

Asimismo, también se abordó la función de la proteína vitelogenina producida por hemocitos en el reconocimiento y transmisión de virus. Cabe indicar que ya se ha informado que el gen Vg del insecto se expresa en tejidos distintos al cuerpo graso femenino. Aunque la proteína Vg no se investigó funcionalmente en la mayoría de estos estudios, su acción se ha dilucidado fisiológicamente en algunos casos; y además de esto, también se ha informado del procesamiento específico de tejido de la proteína Vg. Al abordar la relación funcional determinada por la subunidad /composición de dominio LsVg, aquí se ha confirmado la posibilidad de que la vitelogenina procesada proteolíticamente con diferentes dominios, pueda mediar en funciones específicas, siendo esta investigación uno de los pocos estudios que ha clasificado la función de la vitelogenina según su subunidad o composición de dominio.
Debido a que el cuerpo graso de L. striatellus carece de dominios de unión a microbios, no desempeña ningún papel en la mediación de la transmisión del VSR. Sin embargo, la subunidad de la proteína contiene un péptido señal para la secreción y un sitio de reconocimiento para la unión al receptor y, por tanto, se espera que sea secretada y luego captada por los ovocitos.
En general, la hemolinfa de artrópodos es hostil a los patógenos porque contiene hemocitos circulantes y proteínas antimicrobianas. En consecuencia, los virus adquiridos a través del intestino medio del insecto, se pueden transportar a otros tejidos solo después de un escape exitoso de dicho ambiente. Sin embargo, los estudios han revelado que un microbio transmitido con éxito, puede protegerse contra el sistema inmunitario del huésped mediante la explotación de las proteínas de la hemolinfa del huésped, transformando así la hemolinfa del huésped en un entorno relativamente benigno. Los ejemplos de esto, incluyen la transmisión del virus del arrollamiento de la papa por el áfido verde del melocotón Myzus persicae y la transmisión del virus del rizo de la hoja amarilla del tomate por la mosca blanca Bemisia tabaci. En estos casos, los virus obtienen protección y logran una transmisión exitosa al unirse a una proteína producida por las bacterias endosimbióticas del insecto.
Mientras que por otro lado, en estudios anteriores, se ha revelado que la vitelogenina de peces tiene funciones inmunológicas. Al unirse al patógeno, ésta puede neutralizar y/o matar al patógeno, ya sea directa o indirectamente, ya que las opsoninas median la fagocitosis de macrófagos. Sin embargo, no está claro si el reconocimiento por vitelogenina de un vector artrópodo daría como resultado una tolerancia del virus.
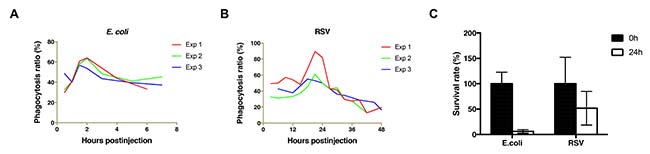
En este estudio, se reveló que la hemolinfa de L. striatellus es un ambiente relativamente benigno para el virus RSV. El RSV tiende a eliminarse de la hemolinfa lentamente. Así pues, cuando se administró E. coli en la hemolinfa de L. striatellus, el nivel máximo de fagocitosis se alcanzó 1,5-2h después de la inyección, y el número de bacterias en la hemolinfa (incluso en los hemocitos) se redujo dramáticamente a <20% dentro de 24h. Por el contrario, cuando se administró la suspensión de RSV en la hemolinfa, la fagocitosis máxima se alcanzó aproximadamente 20h después de la inyección, y el 50% del virus se mantuvo en la hemolinfa (incluidos los hemocitos) después de 24h.
Con esto, al descubrir una correlación positiva entre la presencia de vitelogenina y la supervivencia de RSV en la hemolinfa, este estudio ha proporcionado pistas sobre la contribución de la interacción RSV-LsVg a la protección del RSV en la hemolinfa y al desarrollo de un entorno benigno de hemolinfa de L. striatellus durante la transmisión de RSV. Esta interacción vector-Vg-virus, puede ser un mecanismo molecular común para facilitar el paso del virus a través de la hemolinfa del vector.
En resumen, este estudio ha revelado que la proteína vitelogenina de insecto se somete a un procesamiento específico del tejido, con la forma molecular producida específicamente por los hemocitos utilizados por el virus para ayudar a su supervivencia en la hemolinfa, lo que facilita la transmisión del virus.
Se requieren análisis detallados de las interacciones moleculares entre el virus y su insecto vector para la explotación de nuevas estrategias de control de virus que se dirigen a puntos específicos en el ciclo de vida del virus e interfieren con la transmisión del virus.
Fuente publicación
Este artículo fue publicado originalmente en la revista “PLOS Pathogens” bajo la referencia: Huo Y, Yu Y, Chen L, Li Q, Zhang M, Song Z, et al. (2018) Insect tissue-specific vitellogenin facilitates transmission of plant virus. PLoS Pathog 14(2): e1006909. https://doi.org/10.1371/journal.ppat.1006909; estando disponible con acceso libre en el enlace de dicha revista.


